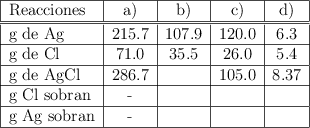
Reaccionan 20 g de carbono y 40 g de oxígeno para formar dióxido de carbono. Si la proporción en que deben estar el carbono y el oxígeno para formar esa sustancia es de 3 : 8, ¿están las masas de carbono y oxígeno en la relación indicada en la ley de Proust? ¿Cuál de ellos sobrará? ¿Cuántos gramos de dióxido de carbono se formarán?
 EjerciciosFyQ
EjerciciosFyQ