Un proceso industrial necesita 36 200 kJ que se obtienen quemando, en condiciones estándar, 422 L de una mezcla de etano y propano. Calcula:
a) El calor de combustión del etano y del propano.
b) La composición molar, en porcentaje, del gas utilizado.
Datos en kJ/mol:
![]() ;
; ![]() ;
; ![]() ;
; ![]()
Si se sabe que una reacción es endotérmica en una dirección, ¿qué puede decirse de la reacción en sentido opuesto?
¿Por qué un proceso se dice endotérmico?
La descomposición del monóxido de nitrógeno transcurre según:
![]()
Siendo ![]() y
y ![]() .
.
a) ¿Es la reacción espontánea en condiciones estándar?
b) ¿A partir de qué temperatura será espontánea?
Dada la reacción:
![]()
a) Dibuja el diagrama de entalpía teniendo en cuenta que las energías de activación para la reacción directa e inversa son 134 kJ/mol y 360 kJ/mol.
b) Justifica si la reacción directa es exotérmica o endotérmica.
La reacción entre 1 g de Zn y ácido sulfúrico en exceso desprende 2 405 J en un recipiente abierto y 2 443 J en un recipiente cerrado. Escribe la reacción ajustada y explica por qué se produce esa diferencia.
Para la reacción:
![]()
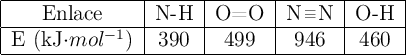
a) Calcula la entalpía de reacción estándar a ![]() , a partir de las entalpías de enlace y de las entalpías de formación en las mismas condiciones de presión y temperatura.
, a partir de las entalpías de enlace y de las entalpías de formación en las mismas condiciones de presión y temperatura.
b) Sabiendo que el valor de ![]() de la reacción es
de la reacción es ![]() y utilizando el valor de
y utilizando el valor de ![]() de la reacción obtenido a partir de los valores de las entalpías de formación, calcula el valor de
de la reacción obtenido a partir de los valores de las entalpías de formación, calcula el valor de ![]() , a
, a ![]() .
.
Datos: ![]() ;
; ![]() ;
; ![]() . Entalpías de enlace en kJ/mol: (C-H) = 414 ; (Cl-Cl) = 243 ; (C-Cl) = 339 ; (H-Cl) = 432.
. Entalpías de enlace en kJ/mol: (C-H) = 414 ; (Cl-Cl) = 243 ; (C-Cl) = 339 ; (H-Cl) = 432.
La reacción utilizada para la soldadura aluminotérmica es:
![]()
a) Calcula el calor a presión constante y el calor a volumen constante intercambiados en condiciones estándar y a la temperatura de la reacción.
b) ¿Cuántos gramos de ![]() se habrán obtenido cuando se desprendan 10 000 kJ en la reacción?
se habrán obtenido cuando se desprendan 10 000 kJ en la reacción?
Datos: ![]() ;
; ![]() . Masas atómicas: Al = 27 ; O = 16.
. Masas atómicas: Al = 27 ; O = 16.
Dada la ecuación termoquímica, a ![]() :
:
![]()
Calcula:
a) El calor de la reacción a volumen constante.
b) La energía libre de Gibbs a la temperatura de ![]() .
.
Datos: ![]() ;
; ![]() ;
; ![]() ;
; ![]()
Para la siguiente reacción:
![]()
Calcula:
a) La entalpía de reacción estándar.
b) La variación de energía interna (calor a volumen constante) a ![]() .
.
Datos: ![]()
 Ejercicios FyQ
Ejercicios FyQ