Una disolución de ácido sulfúrico tiene una concentración del ![]() en peso y una densidad de 1.05 g/mL. Calcula su: a) molaridad; b) molalidad y c) normalidad. (S = 32; O = 16; H = 1)
en peso y una densidad de 1.05 g/mL. Calcula su: a) molaridad; b) molalidad y c) normalidad. (S = 32; O = 16; H = 1)
El bórax (![]() ) es un compuesto con múltiples usos que se disuelve muy fácilmente en agua. Si diluimos 50 mL de una disolución al
) es un compuesto con múltiples usos que se disuelve muy fácilmente en agua. Si diluimos 50 mL de una disolución al ![]() de bórax (
de bórax (![]() ) hasta los 150 mL con agua destilada:
) hasta los 150 mL con agua destilada:
a) ¿Cuál es la molaridad de la disolución final?
b) ¿Cuántos moles de boro contiene?
c) ¿Cuántos átomos de sodio habrá?
Datos: Na = 23 ; B = 10.8 ; O = 16 ; H = 1
a) ¿Cuántos gramos son 1.5 moles de sacarosa, ![]() ?¿Cuántos moles de átomos de carbono contienen?
?¿Cuántos moles de átomos de carbono contienen?
b) Determina la masa, en kg, de ![]() moléculas de
moléculas de ![]() .
.
c) Indica el número de átomos de nitrógeno que hay en 0.76 g de ![]() .
.
Datos: O = 16 ; C = 12 ; N = 14 ; H = 1.
En ![]() de metano (
de metano (![]() ), medido en condiciones normales de presión y temperatura, calcula:
), medido en condiciones normales de presión y temperatura, calcula:
a) El número de moles de metano.
b) El número de moléculas de metano.
c) El número de átomos de hidrógeno.
Calcula la normalidad de una disolución formada por 15 g de cada una de las siguientes sustancias en 100 mL de agua: a) ![]() ; b) KOH
; b) KOH
Se preparó una disolución 0,3 M de ![]() . Calcula su normalidad y su concentración en sulfatos expresada en mg/mL.
. Calcula su normalidad y su concentración en sulfatos expresada en mg/mL.
Calcula el volumen de oxígeno necesario para que reaccione totalmente con 2 kg de propano, si la reacción tiene lugar a una temperatura de ![]() y a una presión de 1.03 atm.
y a una presión de 1.03 atm.
Un recipiente cilíndrico contiene 0.13 g de etano, calcula:
a) El número de moles de etano.
b) El número de moléculas de etano.
c) El número de átomos de carbono.
Datos: C =12 ; H = 1.
Una disolución de 2.04 g de hemoglobina en 100 mL de disolución tiene una presión osmótica igual a 5.83 mm Hg, a ![]() . ¿Cuál es la masa molecular de la hemoglobina?
. ¿Cuál es la masa molecular de la hemoglobina?
El cinc es atacado por el ácido clorhídrico y su reacción desprende hidrógeno. Si una muestra de 15 g se hace reaccionar con ácido en exceso y libera 3,44 L de hidrógeno medidos a 27 ºC y 1 atm:
a) ¿Cuál es la riqueza de la muestra?
b) ¿Qué volumen de ácido 0,3 M haría falta para tratar 1,5 g de muestra?
Datos: Zn = 65,4 u ; Cl = 35,5 u ; H = 1 u ; R = 0,082 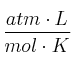
 Ejercicios FyQ
Ejercicios FyQ