¿Cuál es la equivalencia entre un quilate y la concentración en porcentaje en masa?
¿Cuántas moléculas de ![]() reaccionan con 500 g de K teniendo en cuenta la ecuación:
reaccionan con 500 g de K teniendo en cuenta la ecuación: ![]() ?
?
La abundancia del fluoruro en el mar es de 1 g de fluoruro por tonelada de agua. Supón que se pudiese encontrar un método comercial factible para extraer flúor del agua del mar, ¿qué masa de fluoruro podría obtenerse a partir de ![]() de agua de mar?
de agua de mar?
Dato: ![]() .
.
En 3.63 g de un compuesto de oxígeno y calcio hay 2 g de calcio. Halla la formula empírica de este compuesto.
Un óxido de magnesio contiene ![]() de metal. ¿Cuál es su fórmula empírica?
de metal. ¿Cuál es su fórmula empírica?
Determina la fórmula empírica de un compuesto cuya composición centesimal es:
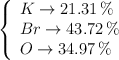
¿Cuál es su nombre sistemático?
Una sustancia, que se sabe que es un abono, contiene el ![]() de N, el
de N, el ![]() de O y el resto de H. ¿Cuál es su fórmula empírica? (N = 14; O = 16; H = 1)
de O y el resto de H. ¿Cuál es su fórmula empírica? (N = 14; O = 16; H = 1)
Determinar la fórmula empírica de una sustancia contiene el ![]() de Na, el
de Na, el ![]() de O y el resto de hidrógeno.
de O y el resto de hidrógeno.
(Datos: Na = 23 ; O = 16 ; H = 1)
¿Cuál es la fórmula molecular de una sustancia cuya análisis arrojó que su fórmula empírica es ![]() y masa molecular es 88 g/mol?
y masa molecular es 88 g/mol?
En la combustión de 7.85 g de una sustancia orgánica formada por C, H y O, se forman 15 g de ![]() y 9.21 g de
y 9.21 g de ![]() . Si su masa molecular es 92 g/mol. ¿Cuál es su fórmula molecular?
. Si su masa molecular es 92 g/mol. ¿Cuál es su fórmula molecular?
 Ejercicios FyQ
Ejercicios FyQ