Por combustión de 0.5 g de una sustancia formada por C, H y O se obtuvieron 0.69 g de ![]() y 0.56 g de
y 0.56 g de ![]() . Al vaporizar 1.6 g de esta sustancia se obtuvieron
. Al vaporizar 1.6 g de esta sustancia se obtuvieron ![]() de vapor en condiciones normales de P y T. Halla la fórmula molecular de la sustancia.
de vapor en condiciones normales de P y T. Halla la fórmula molecular de la sustancia.
Si 60 g de carbono se combinan con 10 g de hidrógeno para formar un hidrocarburo, ¿cuál es la formula molecular de este compuesto?
Un compuesto formado por Fe, S y O tiene la siguiente composición porcentual: ![]() ,
, ![]() y
y ![]() respectivamente. ¿Cómo se llama el compuesto?
respectivamente. ¿Cómo se llama el compuesto?
Masas atómicas: Fe = 55.8 ; S = 32.0 ; O = 16.0
Una sustancia gaseosa contiene un ![]() de carbono, un
de carbono, un ![]() de hidrógeno y el resto de oxígeno. Si su masa molar es de 74 g/mol. Determina cuáles serán sus fórmulas empírica y molecular.
de hidrógeno y el resto de oxígeno. Si su masa molar es de 74 g/mol. Determina cuáles serán sus fórmulas empírica y molecular.
Un compuesto tiene la siguiente composición centesimal: ![]() y
y ![]() . Sabiendo que su masa molecular es
. Sabiendo que su masa molecular es ![]() , determina su fórmula empírica y su fórmula molecular.
, determina su fórmula empírica y su fórmula molecular.
Calcula las fórmulas empírica y molecular de un compuesto orgánico cuya composición centesimal es:
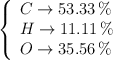
Escribe y nombra dos isómeros sabiendo que su masa molecular es de 90 g/mol.
Un gas que está a 427 K de temperatura y 56 de atm de presión, ocupa un volumen de 14 L. ¿Qué temperatura alcanzará si su volumen pasa a ser de 70 L y la presión de 80 de atm?
A un paciente se le administran cada 12 horas 750 mL de un suero que contiene un ![]() (m/V) de glucosa. ¿Cuántos gramos de glucosa se le administran al paciente diariamente?
(m/V) de glucosa. ¿Cuántos gramos de glucosa se le administran al paciente diariamente?
El líquido de una batería ordinaria para automóviles es una solución acuosa de ácido sulfúrico 5 M. ¿Cuántos gramos de ácido sulfúrico, ![]() , hay en 500 mL de esta solución?
, hay en 500 mL de esta solución?
Una disolución de azúcar tiene una concentración del ![]() (m/m). ¿Cuántos gramos de azúcar habrá en 1.5 L de la disolución?
(m/m). ¿Cuántos gramos de azúcar habrá en 1.5 L de la disolución?
 Ejercicios FyQ
Ejercicios FyQ