La densidad de un gas que se comporta como ideal es ![]() a 2 atm y
a 2 atm y ![]() . ¿Cuál es su peso molecular?
. ¿Cuál es su peso molecular?
Se dispone de 6 g de una muestra que contiene cromato de plata y cromato de hierro(III). Luego de separar y tratar sus componentes, se obtienen 0.675 g de hierro. ¿Cuál es el porcentaje másico de cromo contenido en la muestra original?
Masas atómicas: Cr = 52 ; Ag = 108 ; O = 16 ; Fe = 56
Para determinar el porcentaje de plomo en una muestra se toman 12.3 g de la muestra y se disuelven en 250 mL de agua. Se toman 100 mL de la disolución y se procede a la precipitación del plomo con sulfatos, obteniéndose un peso seco de sulfato de plomo(II) de 1.44 g. ¿Cuál es el porcentaje de plomo en la muestra?
Datos: Pb = 207 ; S = 32 ; O = 16.
El plomo se combina con el oxígeno para dar ![]() . Si se hace reaccionar una muestra de 12.5 g, que contiene plomo y otras sustancias inertes, y en la reacción se producen 11.544 g de óxido de plomo, gastándose para ello 1.544 g de oxígeno, ¿qué porcentaje de plomo contiene la muestra, suponiendo que reacciona todo el plomo presente en la misma?
. Si se hace reaccionar una muestra de 12.5 g, que contiene plomo y otras sustancias inertes, y en la reacción se producen 11.544 g de óxido de plomo, gastándose para ello 1.544 g de oxígeno, ¿qué porcentaje de plomo contiene la muestra, suponiendo que reacciona todo el plomo presente en la misma?
Cuando la presión de un gas se incrementa de 3 atm a 8 atm y la temperatura de 27 °C a 127 °C. Cuál es el porcentaje de variación de volumen?
a) Calcula la presión manométrica, expresada en bar, que corresponde a una presión absoluta de 2.30 bar.
b) Determina la presión absoluta, en bar, equivalente a una lectura de 500 mbar de vacío.
Considera que la presión atmosférica es 930 mbar en ambos casos.
Tres frascos de 1 L, todos a ![]() , han sido intercomunicados mediante espitas inicialmente cerradas. El primer frasco contiene 1 g de
, han sido intercomunicados mediante espitas inicialmente cerradas. El primer frasco contiene 1 g de ![]() , el segundo contiene
, el segundo contiene ![]() a la presión de 1 atm y el tercero 1 g de
a la presión de 1 atm y el tercero 1 g de ![]() . A la temperatura de
. A la temperatura de ![]() , la presión de vapor del agua es 0.038 atm. Calcula:
, la presión de vapor del agua es 0.038 atm. Calcula:
a) La presión inicial en cada frasco.
b) Si se abren las espitas y se espera a que se alcance el equilibrio, ¿cuál será la presión en el sistema?
c) Si la temperatura del sistema se eleva a ![]() , ¿cuál será entonces la presión?
, ¿cuál será entonces la presión?
Una llanta tiene forma de toroide, cuyo volumen se puede calcular a partir de los parámetros R y r de la figura y aplicando la fórmula ![]() :
:
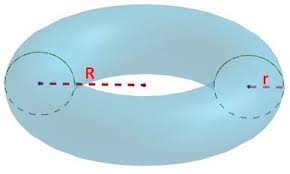
(siendo R = 42.5 cm y r = 17.5 cm).
Cierto día se llenó la llanta con aire a temperatura ambiente (![]() ) y una presión manométrica de 20 psi. Al finalizar el viaje la temperatura de la llanta se elevó a
) y una presión manométrica de 20 psi. Al finalizar el viaje la temperatura de la llanta se elevó a ![]() . Considerando que la presión atmosférica es 12.8 psi calcula:
. Considerando que la presión atmosférica es 12.8 psi calcula:
a) La presión manométrica que registrará la llanta al finalizar el viaje, considerando que el volumen se mantiene constante. Recuerda que para usar las leyes de los gases se debe usar la presión absoluta en todos los cálculos.
b) La masa de aire que se perdió durante el recorrido si la presión manométrica que registra en las condiciones finales fuese de 15 psi.
Considera que la masa molar del aire es 29 g/mol.
Se desea comprimir 10 lb de ![]() a un volumen de 20
a un volumen de 20 ![]() . Calcula la presión, en psi (
. Calcula la presión, en psi (![]() ), a la que es necesario llevar al gas siendo la temperatura de
), a la que es necesario llevar al gas siendo la temperatura de ![]() .
.
Dato: ![]() ; C = 12 ; O = 16.
; C = 12 ; O = 16.
Siendo la presión total de un recipiente 680 torr, ¿cuál es la presión parcial de cada gas, sabiendo que están contenidos 4 litros de cloro, 7 litros de nitrógeno y 6 litros de oxígeno?
 Ejercicios FyQ
Ejercicios FyQ