Cuando se quema una mezcla de gasolina y aire en un cilindro de un motor de explosión, se liberan 104 kJ. Si los gases producidos en la reacción de combustión mueven el pistón realizando un trabajo de 42 kJ, calcula la variación de energía interna que se produce en el proceso.
Calcula la variación de la energía interna en un sistema si pierde 120 calorías y al mismo tiempo se realiza un trabajo sobre él de 70 julios.
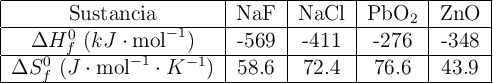
Calcula el incremento de energía libre estándar para las siguientes reacciones:
![]()
![]()
Comenta qué piensas sobre la posibilidad de utilizar estas reacciones en la obtención de flúor y plomo respectivamente. Datos:
Una gominola en forma de oso contiene 2.67 g de sacarosa, (![]() ). Cuando reacciona con 7.19 g de clorato de potasio, (
). Cuando reacciona con 7.19 g de clorato de potasio, (![]() ), se producen 43.7 kJ de calor. Determina el cambio de entalpía para la reacción:
), se producen 43.7 kJ de calor. Determina el cambio de entalpía para la reacción:
![]()
Masas atómicas: K = 39 ; O = 16 ; C = 12 ; H = 1 ; Cl = 35.5.
Un gas se expande realizando un trabajo de ![]() a una presión constante de
a una presión constante de ![]() . Si el gas ocupa inicialmente un volumen de
. Si el gas ocupa inicialmente un volumen de ![]() , ¿cuál será su volumen final?
, ¿cuál será su volumen final?
Dos recipientes rígidos de igual volumen contienen cada uno 5 moles del mismo gas monoatómico ideal a diferente temperatura ![]() y
y ![]() . Se ponen en contacto térmico y llegan a una temperatura final de equilibrio
. Se ponen en contacto térmico y llegan a una temperatura final de equilibrio ![]() . Calculando el cambio de entropía del universo, decide si el proceso es reversible o no.
. Calculando el cambio de entropía del universo, decide si el proceso es reversible o no.
Nota: ![]() implica procesos reversibles.
implica procesos reversibles.
 Ejercicios FyQ
Ejercicios FyQ