La loción de calamina, que se emplea para aliviar la irritación de la piel, es una mezcla de óxidos de hierro(3+) y cinc. Una muestra seca de 1.022 gramos de calamina se disolvió y se diluyó en ácido hasta 250 mL. Una alícuota de 10 mL de la solución diluida se mezcló con fluoruro de potasio para enmascarar el hierro; después de ajustar a un pH adecuado, el cinc consumió 37.4 mL de EDTA ![]() . Una segunda alícuota de 50 mL, amortiguada adecuadamente, se tituló con 2.2 mL de una solución
. Una segunda alícuota de 50 mL, amortiguada adecuadamente, se tituló con 2.2 mL de una solución ![]() de
de ![]() , según la reacción:
, según la reacción:
![]()
Calcula los porcentajes en masa de ![]() y
y ![]() en la muestra.
en la muestra.
A una cáscara de huevo se le retiraron las membranas y después se secó, dando un peso seco de 5.6130 g. Se atacó con HCl concentrado y una vez filtrada, la disolución resultante se transfirió a un matraz de 250 mL y se enrasó con agua destilada. A continuación, se pipeteó una alícuota de 10 mL de este matraz y se transfirió a un Erlenmeyer al que se añadieron unos mL de disolución tampón pH = 10. La valoración de esa disolución consumió 39.54 mL de EDTA ![]() . Calcula la concentración de calcio en la cáscara del huevo como porcentaje en peso de
. Calcula la concentración de calcio en la cáscara del huevo como porcentaje en peso de ![]() . Expresa el resultado con dos cifras decimales.
. Expresa el resultado con dos cifras decimales.
Se obtuvieron los siguientes datos en el análisis de muestras de agua para el catión ![]() , usando una línea de
, usando una línea de ![]() . Los resultados fueron los siguientes:
. Los resultados fueron los siguientes:
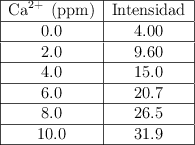
El dato de intensidad medido para una muestra de concentración desconocida fue 11.5. ¿Cuál es la concentración de catión en la muestra?
Los métodos de fluorescencia permiten la identificación y el análisis de drogas de la familia de las fenotiazinas. En el análisis de la clorpromazina se obtuvieron los siguientes datos:
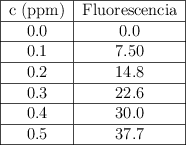
Calcula la concentración de clorpromazina en una solución que tiene una intensidad de fluorescencia de 13.7.
Se desea determinar la concentración de una solución acuosa de iones permanganato (![]() ) mediante espectrofotometría UV-Vis. Para ello, se prepara una curva de calibración midiendo la absorbancia de cinco disoluciones estándar de
) mediante espectrofotometría UV-Vis. Para ello, se prepara una curva de calibración midiendo la absorbancia de cinco disoluciones estándar de ![]() en una cubeta de 1.00 cm de camino óptico. Los datos obtenidos son los siguientes:
en una cubeta de 1.00 cm de camino óptico. Los datos obtenidos son los siguientes:
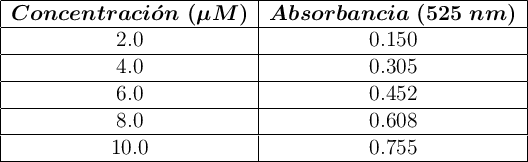
Posteriormente, se mide la absorbancia de una muestra problema diluida 1:5, obteniéndose un valor de 0.523.
a) Determina la ecuación de la curva de calibración y calcula la absortividad molar (![]() ) del
) del ![]() a 525 nm.
a 525 nm.
b) Calcula la concentración de ![]() en la muestra original (antes de la dilución).
en la muestra original (antes de la dilución).
¿Qué concentración tendrá una solución de ![]() si se estandariza con 0.15 g de biftalato de potasio y se consumen 8.0 mL de
si se estandariza con 0.15 g de biftalato de potasio y se consumen 8.0 mL de ![]() ?
?
Masas atómicas: K = 39; O = 16; H = 1; C = 12.
La pureza de una preparación sintética de etilmetilcetona, ![]() , se determina haciéndola reaccionar con clorhidrato de hidroxilamina, liberando HCl. En un análisis típico, 3.00 mL la muestra se diluyen a 50.00 mL y se tratan con un exceso de hidrocloruro de hidroxilamina. El HCl liberado se titula con NaOH 0.8889 M, que requiere 30.6 mL para alcanzar el punto final.
, se determina haciéndola reaccionar con clorhidrato de hidroxilamina, liberando HCl. En un análisis típico, 3.00 mL la muestra se diluyen a 50.00 mL y se tratan con un exceso de hidrocloruro de hidroxilamina. El HCl liberado se titula con NaOH 0.8889 M, que requiere 30.6 mL para alcanzar el punto final.
Calcula la pureza de la muestra, en porcentaje en masa, si la densidad de la etilmetilcetona es ![]() . La reacción general que tiene lugar es:
. La reacción general que tiene lugar es:
![]()
Expresa el resultado con dos cifras decimales.
Una mezcla de ![]() y
y ![]() que pesa 0.6000 g, se trata con 45.7 mL de solución de
que pesa 0.6000 g, se trata con 45.7 mL de solución de ![]() 0.2011 N y el exceso de
0.2011 N y el exceso de ![]() se titula después con disolución de
se titula después con disolución de ![]() 0.1023 N. Si se requieren 22.5 mL. ¿Cuál es el porcentaje de yodo en la muestra?
0.1023 N. Si se requieren 22.5 mL. ¿Cuál es el porcentaje de yodo en la muestra?
Masas atómicas: Li = 7 ; Ba = 137.3 ; I = 127 ; Cl = 35.5
Determina si una reacción con una sensibilidad dada por pD= 4.0 puede servir para detectar 0.2 g de la sustancia en 4.8 L de disolución.
Para conocer el contenido de yoduro de sodio (![]() ) en una muestra se procede de la siguiente forma: se pesan 0.4225 g de nitrato de plata y se disuelven en agua hasta completar 250 mL de disolución. Luego se pesan 15 g de muestra, se disuelven en 50 mL de agua destilada y se añaden 25 mL de la disolución de nitrato de plata previamente preparada. El exceso de nitrato de plata se valora con tiocianato de potasio (
) en una muestra se procede de la siguiente forma: se pesan 0.4225 g de nitrato de plata y se disuelven en agua hasta completar 250 mL de disolución. Luego se pesan 15 g de muestra, se disuelven en 50 mL de agua destilada y se añaden 25 mL de la disolución de nitrato de plata previamente preparada. El exceso de nitrato de plata se valora con tiocianato de potasio (![]() )
) ![]() , consumiéndose 3.1 mL de la disolución del valorante. Calcula el contenido, en mg de
, consumiéndose 3.1 mL de la disolución del valorante. Calcula el contenido, en mg de ![]() por 100 g de muestra.
por 100 g de muestra.
 Ejercicios FyQ
Ejercicios FyQ