2.3 Compuestos ternarios
Son compuestos que están formados por tres átomos de distinta naturaleza. Al igual que vimos en las combinaciones binarias no quiere decir que los compuestos ternarios estén formados por tres átomos, pueden tener un número mayor de átomos pero tienen en común que están formados por tres elementos distintos. En este grupo veremos los hidróxidos, los oxoácidos y las oxosales.
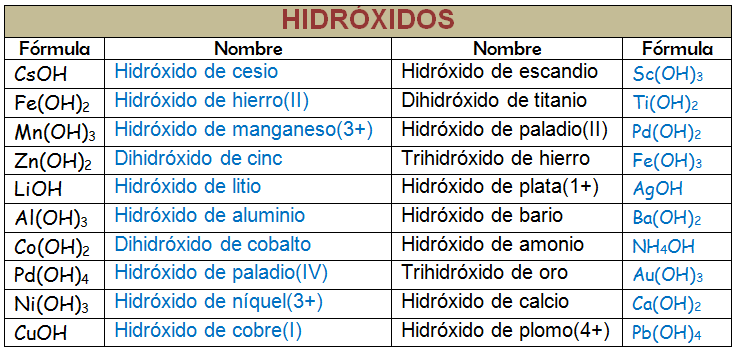
Hidróxidos
Los hidróxidos son compuestos que tienen el grupo (OH)- en su composición. Este grupo es el grupo hidróxido y tiene un número de oxidación -1. Parece claro que sólo podrán formar combinaciones de este grupo con iones positivos (cationes). Vamos a estudiar la combinación del anión hidróxido con cationes metálicos y veremos que no presentan dificultad alguna en la formulación y nomenclatura.
Para formular: Pondremos el símbolo del metal siempre a la izquierda y el grupo (OH)- a la derecha. Después ajusta los subíndices para que la suma de las cargas sea cero. Cuando el subíndice es uno no se escribe el paréntesis para el grupo hidróxido.
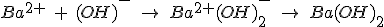
Para nombrar: Leemos de derecha a izquierda la fórmula. Se empieza nombrando el grupo (OH)- seguido de la preposición "de" y luego el nombre del metal. Si existen subíndices debes usar los prefijos numerales. En la siguiente tabla puedes ver algunos ejemplos:
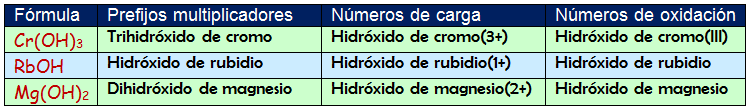
Puedes usar cualquiera de las nomenclaturas de composición porque todas ellas son igual de válidas. Observa que cuando el catión metálico sólo puede presentar un estado de oxidación no es necesario escribirlo en la nomenclatura del número de oxidación pero sí en la de los números de carga.
Ejercicio Resuelto
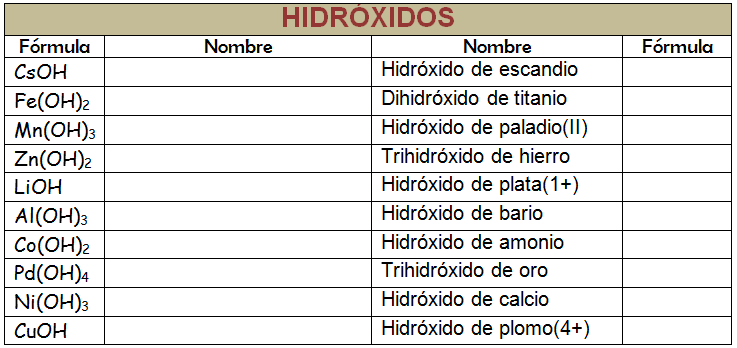
Completa la tabla siguiente y recuerda que puedes nombrar de varias formas distintas y todas son válidas. Cuando hayas terminado puedes comparar tu tabla con la que se propone en la solución. Si tienes dudas debes consultarlas con tu profesor o profesora.
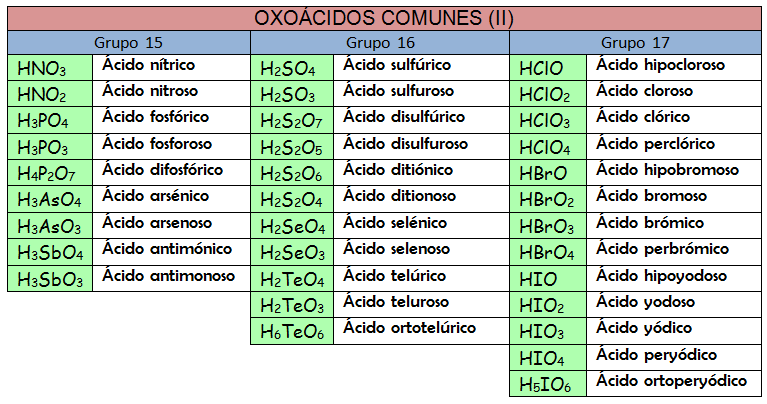
Oxoácidos
Son compuestos ternarios que tienen en su composición átomos de hidrógeno y oxígeno. El otro átomo puede ser un átomo no metálico e incluso de metales como el cromo o el manganeso.Se pueden nombrar según la nomenclatura de adición, la nomenclatura de hidrógeno o usando los nombres tradicionales (ya que la IUPAC lo permite). Quizás el modo más sistemático y más fácil para nombrar los oxoácidos sea la nomenclatura de hidrógeno pero es necesario conocer las otras formas de nombrar porque podemos encontrarlas en la bibliografía química.
a) Nomenclatura de adición.
Es la nomenclatura sistemática para este tipo de compuestos. Debemos considerar que hay un átomo central (que es el átomo que no es ni hidrógeno ni oxígeno) que está unido a los demás átomos (ligandos). Se comienza nombrando a los ligandos por orden alfabético e indicando la cantidad en la que están por medio de los prefijos numerales. El átomo central es el último que se nombra sin terminación alguna. La tilde sólo se pone en el nombre del átomo central. Veamos algunos ejemplos:
- H2CO3: Consideramos que el carbono está rodeado de dos grupos (OH) y un átomo de oxígeno. Lo podemos escribir como CO(OH)2. Ahora empezamos a nombrar los ligandos y terminamos por el átomo central: dihidroxidooxidocarbono.
- H2SO4: Hacemos igual que antes y reescribimos el compuesto como SO2(OH)2. El nombre nos quedará como dihidroxidodioxidoazufre.
- HNO3: El nitrógeno es el átomo central y está unido a un grupo (OH) y dos oxígenos, NO2OH.Lo nombramos como hidroxidodioxidonitrógeno.
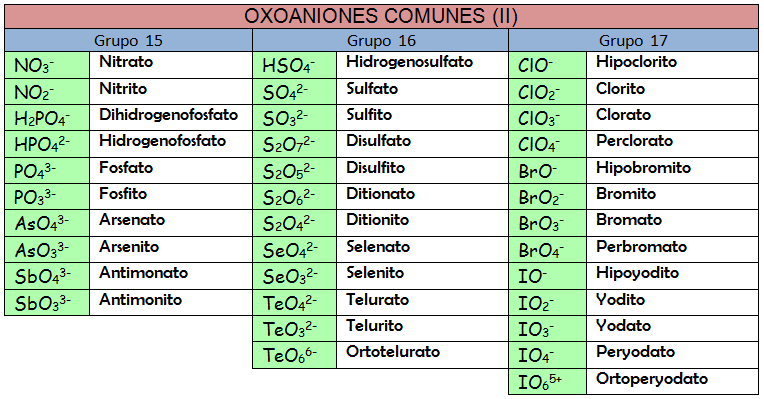
En el caso de que en lugar de una molécula neutra tuviésemos un anión, es decir, un ácido que ha perdido algún o todos sus átomos de hidrógeno, la forma de nombrarlo sería análoga pero usando el sufijo -ato al final del nombre del átomo central e indicado entre paréntesis la carga del anión:
- HSO3-: Hidroxidodioxidosulfato(1-).
- NO2-: Dioxidonitrato(1-).
- HBO32-: Hidroxidodioxidoborato(2-).
b) Nomenclatura de hidrógeno.
Cuando escribimos los oxoácidos lo hacemos agrupando los átomos de hidrógeno y colocándolos al principio de la fórmula; H2SO4, HMnO4, HClO3... Para nombrar los oxoácidos así escritos podemos usar la nomenclatura de hidrógeno que consiste en poner en primer lugar la palabra hidrogeno (sin tilde), seguida del anión que deriva de la nomenclatura de adición escrito entre paréntesis. Vemos algunos ejemplos:
- HClO3: hidrogeno(trioxidoclorato).
- HMnO4: hidrogeno(tetraoxidomanganato).
- H2SeO4: dihidrogeno(tetraoxidoseleniato).
- HCO3-: hidrogeno(trioxidocarbonato)(1-).
- HPO42-: hidrogeno(tetraoxidofosfato)(2-).
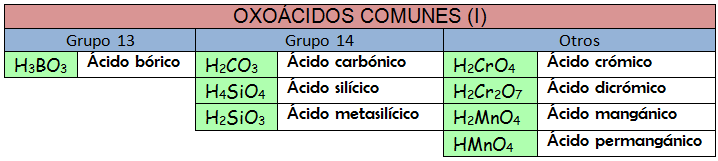
c) Nomenclatura tradicional.
Los nombres tradicionales de los oxoácidos siguen unas reglas que han quedado obsoletas. La mejor manera de enfrentar este tipo de nomenclatura es usar la memoria. Apréndete los nombres de los oxoácidos, así como sus aniones correspondientes, y podrás formular como un «profesional».
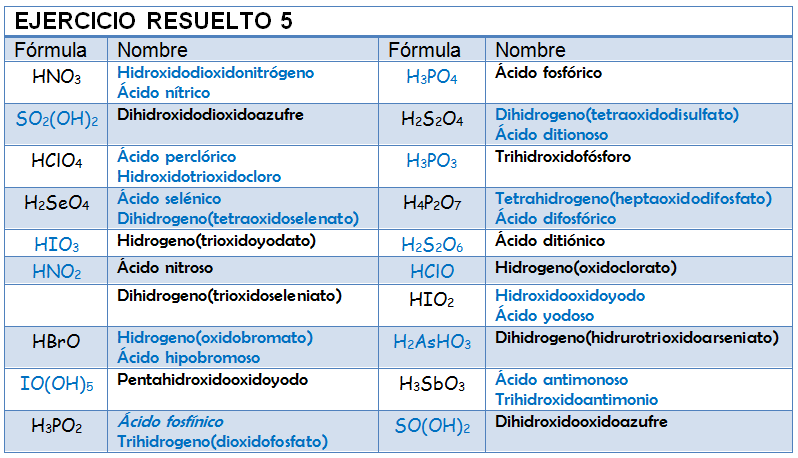
Ejercicio Resuelto
Copia la siguiente tabla en tu libreta y nombra o formula los ácidos que se proponen. Una vez que la hayas completado mira la solución y analiza en qué te has equivocado.
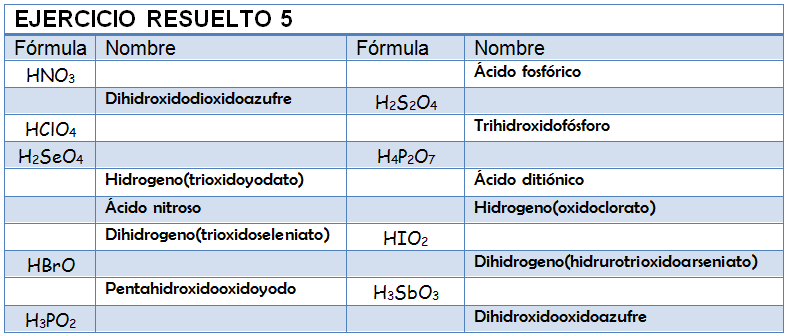
HMnO4:
H2SO3:
HBrO2:
Cr2O72-:
H2PO4-:
ClO4-:Oxosales
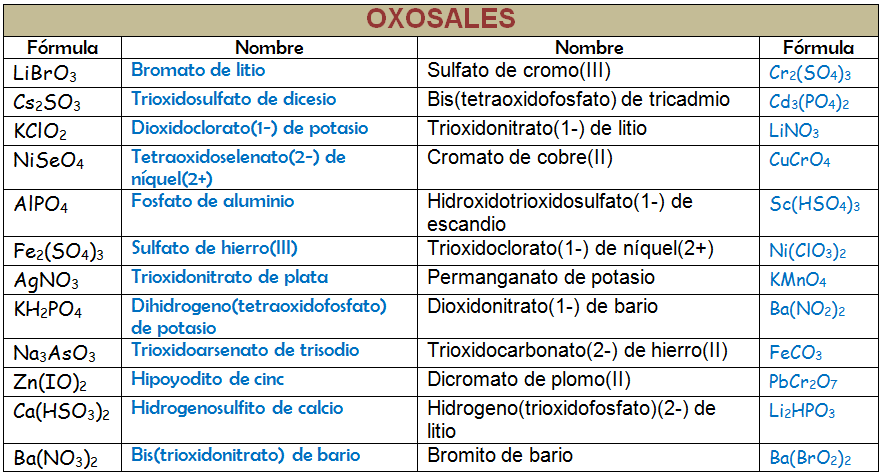
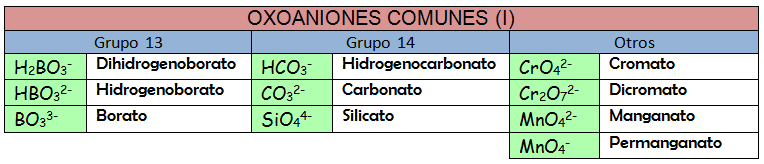
Vamos a considerar a la oxosales como compuestos formados por dos partes: una parte positiva (catiónica) que suele ser un catión metálico y otra negativa (aniónica) que será un oxoanión, es decir, deriva de un oxoácido que ha perdido todos o alguno de sus hidrógenos. La forma de nombrarlo será, por tanto, usando la nomenclatura de composición. Recuerda que puedes usar los prefijos multiplicadores, los números de oxidación o los números de carga. La diferencia con las combinaciones binarias del epígrafe 2.2 es que el nombre del oxoanión puede darse de cualquiera de las formas que acabamos de ver y eso es lo que puede resultar confuso al principio. Probemos a nombrar las siguientes oxosales: KNO3, (NH4)2SO4 y Ni2(CrO4)3.
Vamos a hacer algún ejemplo más:
Ba(HCO3)2: Fíjate que la parte catiónica no tiene subíndice alguno y que se trata de un metal del grupo 2, por lo que su estado de oxidación es único (2+). Podríamos nombrar como bis(hidrogenotrioxidocarbonato) de bario (usando la nomenclatura de composición de los prefijos numerales). También sería válido el nombre hidrogenotrioxidocarbonato(1-) de bario, si usamos la nomenclatura de composición de los números de carga. Podríamos usar la nomenclatura aceptada por la IUPAC para la parte aniónica y quedaría como hidrogenocarbonato de bario. Con compuestos que contienen hidrógeno en la parte aniónica, como es este caso, se puede nombrar la parte aniónica según la nomenclatura de adición. El nombre que quedaría es hidroxidodioxidocarbonato(1-) de bario.
Au2SO3: El metal ahora sí que puede tener más de un estado de oxidación y debemos especificar que se trata del (1+). Si recurrimos a la nomenclatura de composición usando los prefijos numerales nombraremos la sal como trioxidosulfato de dioro. Si usamos los números de carga deberíamos escribir trioxidosulfato(2-) de oro(1+). La nomenclatura de composición con número de oxidación sería sulfito de oro(I) y está aceptada por la IUPAC.
Es imporante que te des cuenta de que pueden ser correctos muchos nombres distintos. Podrás nombrar como quieras pero, si lees la ponencia de Química de 2011, verás que en la prueba de acceso a la Universidad ellos van a usar la nomenclatura de composición aceptada por la IUPAC. Es muy importante que memorices los oxoácidos y oxoaniones de las tablas.
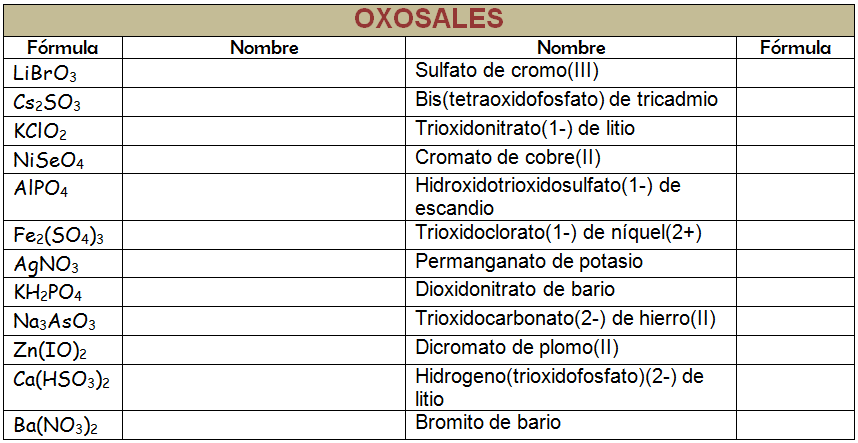
Ejercicio Resuelto
Copia la tabla siguiente en tu libreta de clase y complétala. Nombra los compuestos como quieras pero siempre siguiendo las normas que has aprendido:
Li2Cr2O7: Heptaoxido de dilitio
Fe(NO3)2: Nitrato de hierro
Mn2(SO4)3: Tris( sulfato)(2-) de manganeso(3+)
CsNO2: Ni de cesio
Hg(IO3)2: Yodato de
NH4NO3: Nitrato de
Ca2SiO4: Tetraoxido de calcio