Vas a poder trabajar en un laboratorio virtual en el que emular a los grandes científicos que has conocido en este tema.
En el simulador vas a tener que hacer una serie de experimentos.
SIMULADOR
Cuestiones previas a la investigación.
1. Determina el valor de la variable "x" en cada una de las siguientes ecuaciones. Expresa el resultado con el número correcto de cifras significativas.
a)\ 2,57\cdot 3,14 = 1,76x\ \ \ b)\ \frac{2,27}{132} = \frac{x}{304}\ \ \ c)\ \frac{459}{3,05} = \frac{287}{x}
2. Describe brevemente y con tus propias palabras en qué consiste cada una de las siguientes variables termodinámicas y en qué unidades se mide cada una:
a) Temperatura ; b) Presión ; c) Volumen
3. Convierte cada valor de temperatura en escala centígrada en el correspondiente valor en escala absoluta o escala Kelvin:
a) 25 ºC ; b) 40 ºC ; c) 53 ºC
Ley de Boyle.
| Presiona en el enlace del SIMULADOR que está arriba y espera a que cargue la aplicación. Pulsa sobre la pestaña "Boyle's Law" y cambiará su color a blanco. El simulador estará listo para que hagas el primer experimento en ese momento y la temperatura del sistema será constante. |
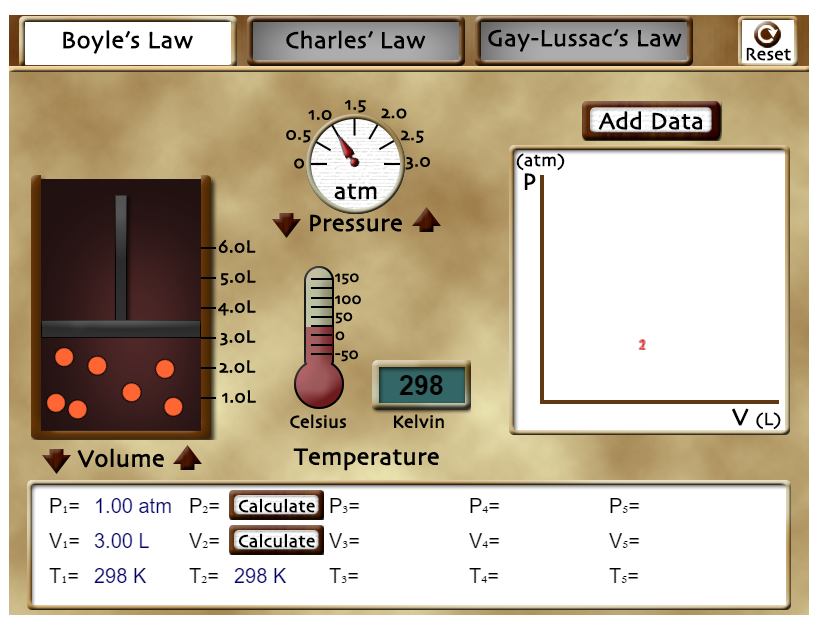 |
PRIMER EJEMPLO.
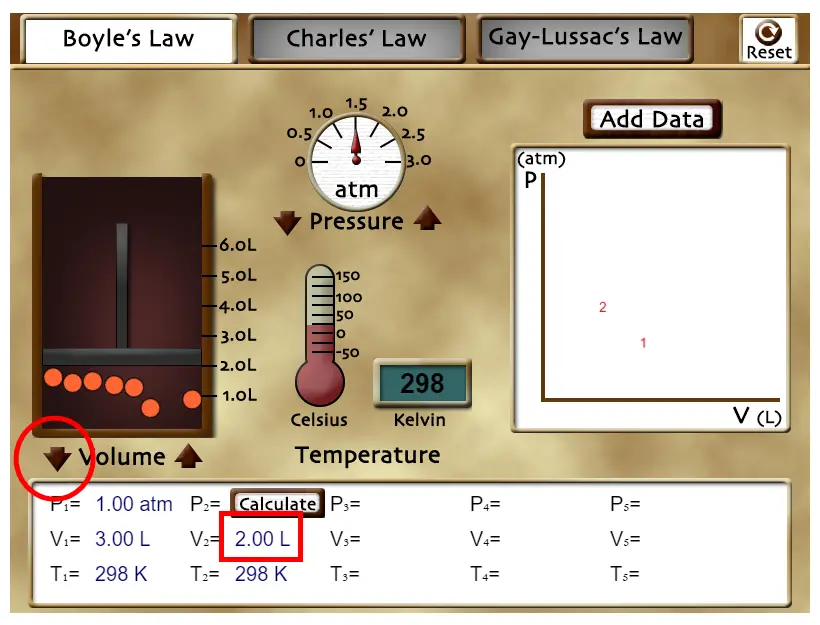 |
Usando las flechas que están al lado de "Volume" puedes aumentar o disminuir el volumen en el que las partículas de gas se pueden mover. Observa que el valor inicial es P1 = 1 atm, V1 = 3,00 L y T1 = 298 K. Ahora varía el volumen hasta llegar al valor V2 = 2 L. Calcula el valor que debería tener P2 y luego presiona sobre "Calculate" en el cuadro de abajo. Podrás comprobar si has realizado el cálculo de manera correcta. Pulsa en el botón "Reset" que está arriba a la derecha del laboratorio. |
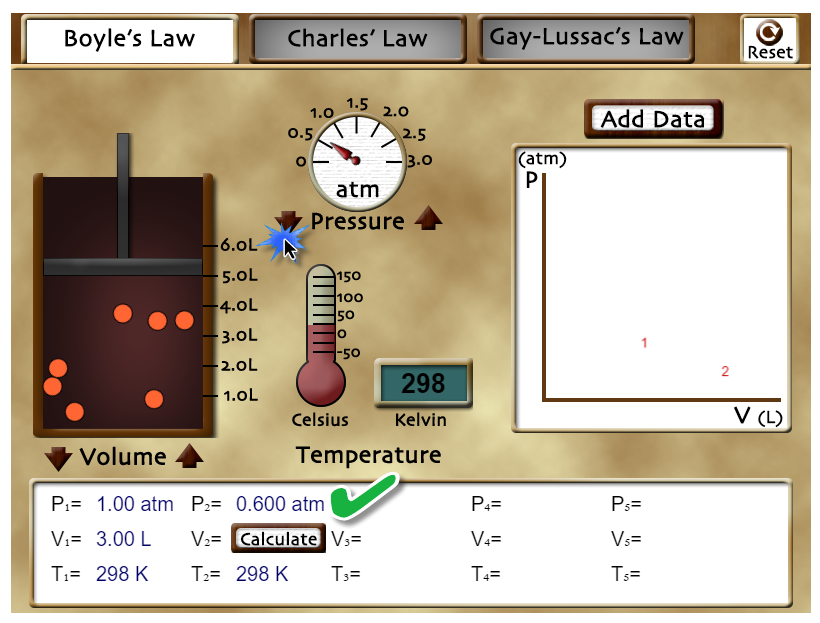
SEGUNDO EJEMPLO.
| Usando las flechas que están al lado de "Pressure" puedes aumentar o disminuir la presión del sistema. Observa que el valor inicial es P1 = 1 atm, V1 = 3,00 L y T1 = 298 K. Ahora varía la presión hasta llegar al valor P2 = 0,600 atm. Calcula el valor que debería tener V2 y luego presiona sobre "Calculate" en el cuadro de abajo. Podrás comprobar si has realizado el cálculo de manera correcta. Pulsa en el botón "Reset" que está arriba a la derecha del laboratorio. |
 |
PRIMER EXPERIMENTO
Usando los controles de la presión, selecciona el valor de 1,30 atm y luego presiona en "Add data", que está encima de los ejes de coordenadas. Vuelve a variar el valor de la presión hasta 1,70 atm y presiona en "Add data". Repite esto mismo con los valores de 2,20 atm y 2,80 atm, presionando en "Add data" entre un valor y otro.
Copia en tu libreta los datos que has obtenido en la experiencia. Recuerda que no es preciso que copies el dato de la temperatura porque es siempre la misma. Ahora responde a las siguientes preguntas:
a) ¿Crees que la presión y el volumen son directa o inversamente proporcionales? ¿Por qué?
b) A partir de lo que sabes sobre la Ley de Boyle, ¿cuál crees que sería la presión de un gas que está en una botella si presionamos ésta lentamente hasta que su volumen se hace la mitad del volumen final? Explica tu respuesta.
Ley de Charles.
|
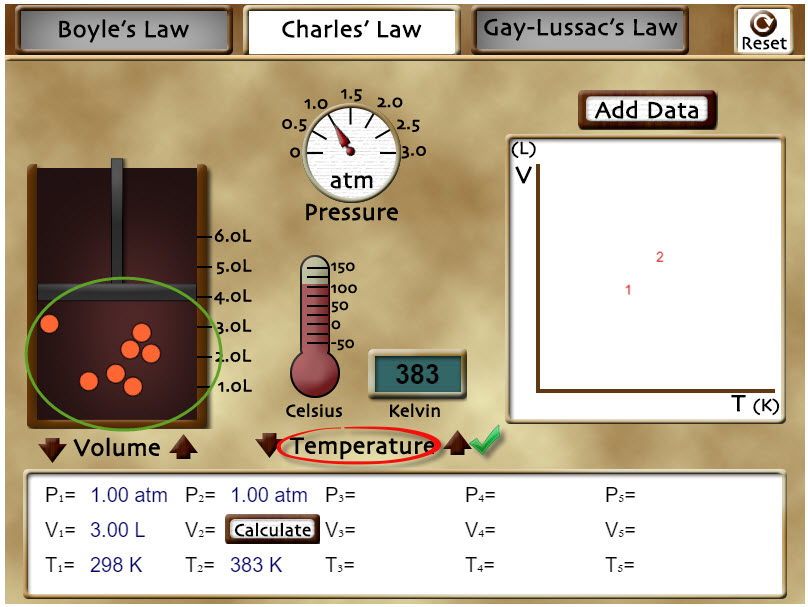
Cambia el simulador a la pestaña de “Charles’ Law”, picando sobre la pestaña hasta que se ponga blanca. En ese momento estará listo para el siguiente experimento y la presión se hace constante.
Usa los controles de "Temperature" para aumentar la temperatura del gas y presta atención a lo que ocurre con el volumen del sistema. ¿Observas algún cambio en el comportamiento de las partículas?
|
 |
PRIMER EJEMPLO.
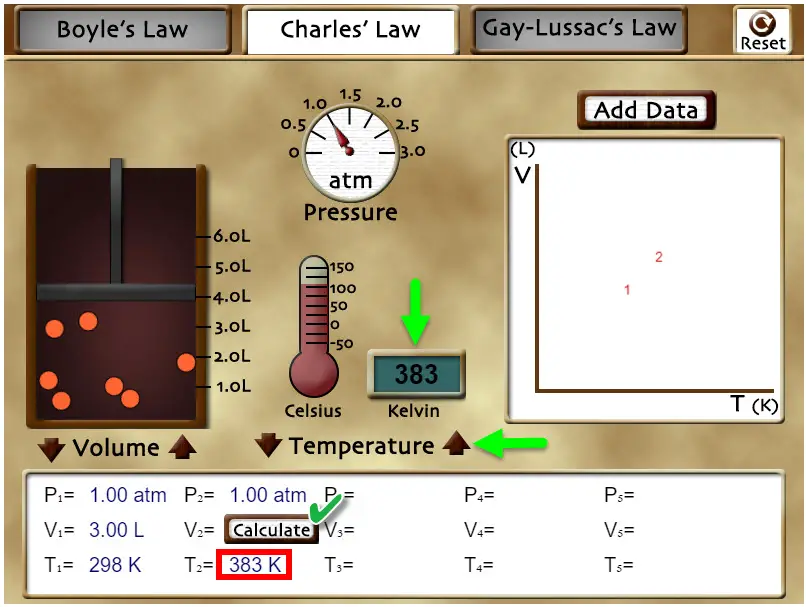 |
Con los controles de "Temperature" selecciona el valor 383 K y, a partir de la ecuación de la Ley de Charles, calcula el valor del volumen del sistema. Puedes comprobar si has hecho bien el cálculo si presionas sobre el botón "Calculate" que la segunda columna. Presiona en "Reset" arriba a la derecha del escenario.
¿Cómo crees que es la relación entre el volumen y la temperatura del sistema, directa o inversamente proporcional? Explica por qué.
|
SEGUNDO EJEMPLO.
| Usa los controles de "Volume" para cambiar el volumen del sistema hasta los 1,50 L y tendrás tu laboratorio como puedes ver en la imagen. Calcula el valor de la temperatura T2 que corresponde a ese volumen a partir de la ecuación de la Ley de Charles. Puede ver si has hecho bien el cálculo si presionas en el botón "Calculate" que está cerca de T2. Presiona en el botón "Reset" arriba a la derecha del laboratorio. |
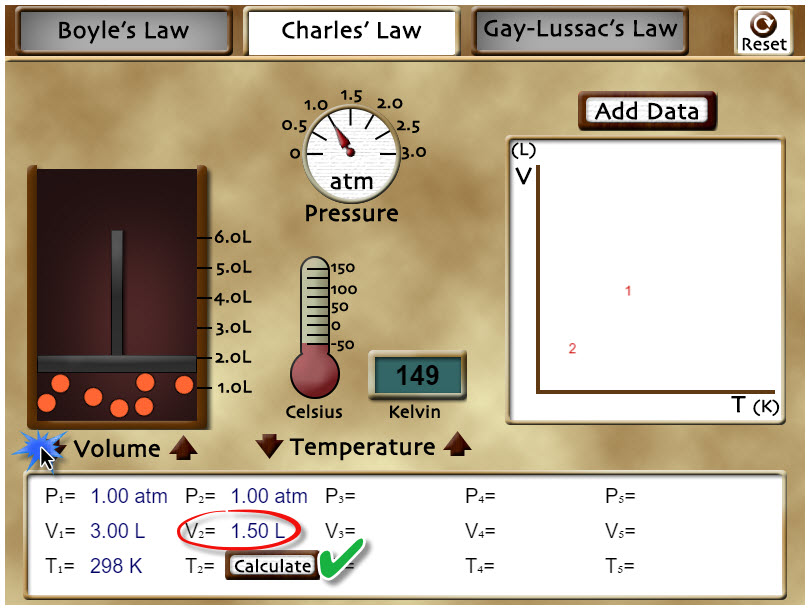 |
SEGUNDO EXPERIMENTO
Usa los controles de "Temperature" para seleccionar cuatro valores menores que el valor inicial de temperatura, (el menor valor posible de temperatura en el laboratorio es 93,0 K), pero recuerda hacer clic en los botones "Add data" y "Calculate" entre cada uno de lo valores que selecciones. En el laboratorio irás dibujando un gráfico similar a ESTE.
Escribe los datos que han quedado grabados en el cuadro blanco y un gráfico parecido al del escenario en tu libreta. Puede ser buena idea construir una tabla para los datos y poner las unidades y valores en el gráfico que hagas en tu libreta. Responde a las siguientes cuestiones:
a) ¿Cuál crees que es la tendencia entre el volumen y la temperatura del gas? ¿Por qué?
b) A partir de lo que sabes sobre la Ley de Charles, ¿cuál sería el valor del volumen del sistema si la temperatura alcanzara el valor 650 K? Representa este punto en tu gráfico. ¿Eres capaz de explicar el resultado?








