-
EBAU Andalucía: química (junio 2012) - ejercicio B.6 (1807)
Dada la ecuación termoquímica, a 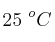 :
:

Calcula:
a) El calor de la reacción a volumen constante.
b) La energía libre de Gibbs a la temperatura de 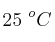 .
.
Datos: ![S^0[\ce{NH3(g)}] = 192.3\ J\cdot (mol\cdot K)^{-1} S^0[\ce{NH3(g)}] = 192.3\ J\cdot (mol\cdot K)^{-1}](local/cache-TeX/0ba576237cd2359701ffb3101fe044b1.png) ;
; ![S^0[\ce{N2(g)}] = 191\ J\cdot (mol\cdot K)^{-1} S^0[\ce{N2(g)}] = 191\ J\cdot (mol\cdot K)^{-1}](local/cache-TeX/66a3363ae2fb51e6a64f40d5f1344dd1.png) ;
; ![S^0[\ce{H2(g)}] = 130.8\ J\cdot (mol\cdot K)^{-1} S^0[\ce{H2(g)}] = 130.8\ J\cdot (mol\cdot K)^{-1}](local/cache-TeX/80f00905c3da256c5c9a06b5487ebaa0.png) ;
; 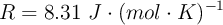
-
EBAU Andalucía: química (septiembre 2010) - ejercicio B.5 (1481)
Considera la reacción de hidrogenación del propino:
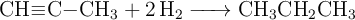
a) Calcula la entalpía de la reacción, a partir de las entalpías medias de enlace.
b) Determina la cantidad de energía que habrá que proporcionar a 100 g de hidrógeno molecular para disociarlo completamente en sus átomos.
Datos: Entalpías de enlace en kJ/mol: (C−C) = 347; (C≡C) = 830; (C−H) = 415; (H−H) = 436.
Masa atómica: H = 1.
-
EBAU Andalucía: química (septiembre 2010) - ejercicio A.2 (1472)
a) Dos átomos tienen las siguientes configuraciones electrónicas 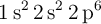 y
y 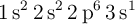 . La primera energía de ionización de uno es 2 080 kJ/mol y la del otro 496 kJ/mol. Asigna cada uno de estos valores a cada una de las configuraciones electrónicas y justifica la elección.
. La primera energía de ionización de uno es 2 080 kJ/mol y la del otro 496 kJ/mol. Asigna cada uno de estos valores a cada una de las configuraciones electrónicas y justifica la elección.
b) La segunda energía de ionización del átomo de helio ¿será mayor, menor o igual que la energía de ionización del átomo de hidrógeno? Razona la respuesta.
-
PAU descriptiva inorgánica 0005
Justifica con cuál de los dos especies químicas de cada apartado reaccionará el HF (aq) en mayor medida. Escribe las reacciones correspondientes:
a) 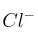 o NaOH
o NaOH
b) 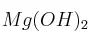 o
o 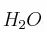
c) 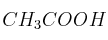 o
o 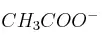
Datos: 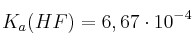 ;
; 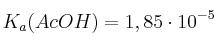
-
PAU descriptiva inorgánica 0004
Tenemos dos disoluciones: una de HF (aq) (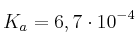 ) y otra de HI (aq) (
) y otra de HI (aq) (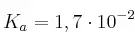 ). Si la concentración de los dos ácidos es la misma, ¿cuál de los dos ácidos es más débil?
). Si la concentración de los dos ácidos es la misma, ¿cuál de los dos ácidos es más débil?
 PAU
PAU