-
Concentración conocido su orden de reacción y tiempo de semirreacción (6481)
Si el tiempo de vida media de una reacción de primer orden es 25.0 s, ¿cuál era la concentración cuando habían transcurrido 8.00 s si la concentración inicial era de 0.500 M?
-
Energía de activación de una reacción de orden uno y constante de velocidad (6164)
Para la reacción irreversible de primer orden:
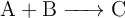
se sabe que la velocidad se hace cuatro veces mayor cuando aumenta la temperatura de 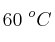 a
a 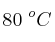 . Teniendo en cuenta que la constante de velocidad a
. Teniendo en cuenta que la constante de velocidad a 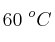 para dicha reacción es
para dicha reacción es 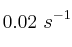 , determina:
, determina:
a) La energía de activación de la reacción (expresada en kJ/mol).
b) La constante de velocidad cuando la reacción se lleva a cabo a 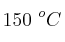 .
.
-
Constante de velocidad de una reacción de segundo orden (5902)
Una reacción hipotética que convierte el reactivo A en producto P es de orden 2 respecto al reactivo. Si se parte de una concentración de A igual a 0.123 M y se determina que al cabo de 10 minutos la concentración de A es de 0.090 M, determina:
a) El valor de la constante de velocidad.
b) La concentración de A después de transcurridos 60 s.
-
Presión total de un sistema gaseoso después de una hora (4811)
El reactivo A se descompone según la reacción: 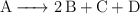 , siendo una reacción homogénena en fase gaseosa. Se tiene un mol de A en un recipiente de 2 L a
, siendo una reacción homogénena en fase gaseosa. Se tiene un mol de A en un recipiente de 2 L a 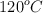 . Halla la presión total del recipiente al cabo de una hora a partir de los datos de la tabla siguiente:
. Halla la presión total del recipiente al cabo de una hora a partir de los datos de la tabla siguiente:

-
Ley cinética y constante de velocidad (2623)
La ley cinética de una reacción es ![v =k[A]^2 v =k[A]^2](local/cache-TeX/8fd5f91e9d6d2eaa1ed8f81761c19430.png) , para una reacción química simple. Si la velocidad fue de
, para una reacción química simple. Si la velocidad fue de 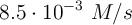 cuando [A] era 0.2 M, ¿cuál será [A] si la velocidad es
cuando [A] era 0.2 M, ¿cuál será [A] si la velocidad es  ?
?
 Constante velocidad
Constante velocidad