-
Masa de amoniaco que debe descomponerse para dar 7 g de nitrógeno (6987)
El gas amoniaco se descompone dando hidrógeno y nitrógeno gaseosos:
a) Escribe la ecuación química del proceso.
b) Calcula cuántos gramos de amoniaco se deben descomponer para obtener 7 g de nitrógeno.
c) Calcula la masa de hidrógeno que se obtendrá en ese caso.
Masas atómicas: N = 14 ; H = 1.
-
Cálculos estequiométricos en la descomposición de un gas de nitrógeno (6977)
La reacción de descomposición del tetraóxido de dinitrógeno tiene lugar a 263 K y 1 atm de presión, dando lugar a trióxido de dinitrógeno y oxígeno, siendo todas las sustancias gaseosas. Calcula:
a) Si se descomponen 50 g del reactivo, ¿qué masa de oxígeno se obtendrá? ¿Y de trióxido de dinitrógeno?
b) ¿Qué volumen de trióxido de dinitrógeno se obtiene cuando se han recogido 13.5 L de oxígeno? ¿A qué masa equivale si el volumen de oxígeno representan 1.25 moles?
Masas atómicas: N = 14 ; O = 16.
-
Reacción entre el SO2 y el O2 para dar SO3 (6975)
Durante la fabricación del ácido sulfúrico, el dióxido de azufre ( ) se hace reaccionar con oxígeno (
) se hace reaccionar con oxígeno ( ) para obtener trióxido de azufre (
) para obtener trióxido de azufre (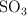 ), también gas.
), también gas.
a) Escribe y ajusta la reacción que tiene lugar.
b) ¿Cuántos gramos de oxígeno hacen falta para reaccionar con 16 g de  ?
?
c) ¿Cuántos gramos de 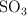 se obtendrán en ese caso?
se obtendrán en ese caso?
-
Masa de FeBr3 que se obtiene a partir de una masa de HBr (5549)
Determina la masa de tribromuro de hierro que se puede obtener a partir de 580 g de bromuro de hidrógeno sabiendo que la reacción que se produce es:
bromuro de hidrógeno + hierro = tribromuro de hierro + hidrógeno
Masas atómicas: H = 1 ; Br = 80 ; Fe = 56.
-
Masa de yoduro de aluminio a partir de 25 g de yodo (4743)
Al hacer reaccionar aluminio metálico con yodo se obtiene triyoduro de aluminio. Calcula la masa de este producto que se obtendrá a partir de 25 g de yodo.
Datos: Al = 27 ; I = 127.
 Relación másica
Relación másica