-
Molaridad de una bebida con zumo de limón (5051)
Se asume que el jugo limón tiene entre un 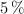 y
y 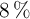 de ácido cítrico (
de ácido cítrico (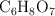 ) en masa y una densidad de 1.049 g/mL. Si se preparan 2 litros de una bebida refrescante con 1 000 mL de jugo de limón, ¿cuál es la concentración molar de esa bebida?
) en masa y una densidad de 1.049 g/mL. Si se preparan 2 litros de una bebida refrescante con 1 000 mL de jugo de limón, ¿cuál es la concentración molar de esa bebida?
-
Porcentajes y molaridad de una solución de glucosa (5035)
Se dispone de 0.250 L de una solución que contiene 9.00 g de glucosa (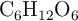 ), siendo la densidad 1.05 g/mL. Calcula el
), siendo la densidad 1.05 g/mL. Calcula el 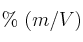 , el
, el 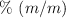 y la molaridad de la solución.
y la molaridad de la solución.
Datos: C = 12 ; H = 1 ; O = 16.
-
Masa de glucosa necesaria para una disolución 0,2 molar
¿Qué cantidad de glucosa, 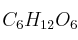 , se necesita para preparar 100
, se necesita para preparar 100 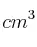 de una solución 0,2 molar?
de una solución 0,2 molar?
Masas atómicas: H = 1 ; C = 12 ; O = 16.
-
Molaridad de un volumen de disolución a partir de su porcentaje en masa y densidad (5006)
Se tienen 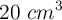 de una solución al
de una solución al 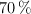 en masa de
en masa de 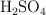 , cuya densidad es de
, cuya densidad es de 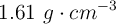 . ¿Cuál es la molaridad total de la solución?
. ¿Cuál es la molaridad total de la solución?
Masas atómicas: H = 1 ; S = 32 ; O = 16.
-
Molaridad de una disolución conocida su molalidad y su densidad (4970)
Calcula la molaridad de una disolución acuosa 1.52 m (molal) de 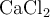 , sabiendo que la densidad de la solución es 1.129 g/mL.
, sabiendo que la densidad de la solución es 1.129 g/mL.
 Molaridad
Molaridad