-
Pureza de una muestra de cinc a partir de su reacción con HCl (4988)
La reacción entre el cinc y el ácido clorhídrico produce cloruro de cinc e hidrógeno. Para determinar la riqueza de un cinc muy impuro se tomaron 5 g de muestra y se hicieron reaccionar con ácido clorhídrico en exceso. El volumen de hidrógeno producido fue de 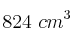 , medido a 1 atm y 298 K, ¿qué porcentaje de cinc hay en la muestra?
, medido a 1 atm y 298 K, ¿qué porcentaje de cinc hay en la muestra?
Datos: 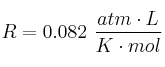 ; Zn = 65.3 g/mol.
; Zn = 65.3 g/mol.
-
Masa de nitrato de sodio a partir de ácido nítrico y carbonato de sodio (4971)
Se hacen reaccionar 10 moles de ácido nítrico con carbonato de sodio. Determina cuántos gramos de nitrato de sodio se obtienen.
Masas atómicas: Na = 23 ; O = 16 ; N = 14.
-
Masa de nitrato de potasio que descomponer para un volumen de oxígeno dado (4929)
Calcular la masa de nitrato de potasio que hay que descomponer para producir 17.4 litros de oxígeno gaseoso en condiciones normales de presión y temperatura.
Masas atómicas: K = 39; O = 16; N = 14.
-
Masa y mol de reactivo y producto en la oxidación del magnesio (4927)
Cuando reacciona el magnesio (Mg = 24.3 u) con el oxígeno (O = 16 u) se produce óxido de magnesio. Escribe y ajusta la reacción y contesta:
a) ¿Qué masa y cantidad de óxido se obtiene si partimos de 200 g de magnesio?
b) ¿Qué masa y cantidad de oxígeno se consume en el caso anterior?
c) ¿Cuántas moléculas de oxígeno reaccionan cuando se obtiene un mol de óxido?
Número de Avogadro: 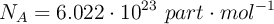 .
.
-
Mol y masa de reactivo y producto en la combustión del carbono (4926)
Calcula, a partir de la reacción ajustada:
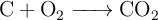
a) La masa y cantidad de oxígeno necesaria para reaccionar con 10 g de carbono.
b) La masa y cantidad de dióxido de carbono que se obtendrá en el caso anterior.
c) La cantidad de partículas de oxígeno que reaccionan y de dióxido de carbono que se desprenden.
Masas atómicas: C = 12 ; O = 16. Número de Avogadro: 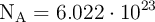
 Reacciones químicas
Reacciones químicas