-
Cálculos sobre la reacción de formación del dióxido de azufre (4460)
Se hace reaccionar azufre con cantidad suficiente de oxígeno para obtener dióxido de azufre. Calcula qué masa de este óxido se puede obtener en los siguientes casos:
a) 3.5 moles de oxígeno.
b) 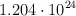 átomos de oxígeno.
átomos de oxígeno.
c) 12 moles de azufre.
d) 8 g de azufre.
e) 3.36 litros de oxígeno, medidos en condiciones normales.
-
Cálculos sobre la reacción de formación del dióxido de carbono 0001
Se desea obtener dióxido de carbono a partir de 30 g de carbono y con exceso de oxígeno. Calcula:
a) Los moles de oxígeno necesarios para la combustión completa.
b) Volumen de ese oxígeno si es medido en condiciones normales.
c) Masa de dióxido de carbono que se obtiene.
d) Número de moléculas de producto que se obtiene.
-
Cálculos sobre la reacción de formación del agua (4458)
5 L de hidrógeno, medidos en condiciones normales de presión y temperatura, reaccionan con cantidad suficiente de oxígeno para formar agua. Indica:
a) La ecuación química del proceso.
b) Los moles de agua que se obtienen.
c) Los litros de oxígeno, en las mismas condiciones, se necesitan.
-
Reacción de formación del trióxido de azufre (4445)
2.5 g de azufre se hacen reaccionan con cantidad suficiente de oxígeno según la reacción:
![\color[RGB]{2,112,20}{\textbf{\ce{S + O2 -> SO3}} \color[RGB]{2,112,20}{\textbf{\ce{S + O2 -> SO3}}](local/cache-TeX/70c3c7420bacbc30f000a54725865750.png)
a) Ajusta la reacción química.
b) Calcula cuántos gramos de trióxido de azufre se obtienen.
c) ¿Cuántos moles de oxígeno reaccionan?
d) ¿Qué volumen ocupa el trióxido de azufre que se forma, medido en condiciones normales de temperatura y presión?
-
Velocidad de la combustión del propano 0001
La velocidad media de una reacción puede ser calculada por la relación entre las variaciones de un reactivo o producto en el intervalo de tiempo en que esto ocurre. De esta forma, en la siguiente reacción, 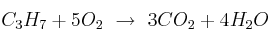 , si se producen de 6 moles de
, si se producen de 6 moles de  en 50 minutos, ¿cuál será la velocidad de la reacción con respecto al propano?
en 50 minutos, ¿cuál será la velocidad de la reacción con respecto al propano?
 Reacciones químicas
Reacciones químicas