-
Número atómico de dos isótopos (4202)
Un elemento posee dos isótopos cuyos números de masa suman 74 y presentan en total 40 neutrones. Halla su número atómico.
-
Abundancia relativa de isótopos del vanadio (4106)
El vanadio presenta dos isótopos naturales: 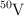 y
y 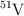 . Sus masas atómicas son: 49.9472 u y 50.9490 u, respectivamente. Sabiendo que la masa atómica promedio del vanadio es 50.9415 u, calcula la abundancia relativa de cada isótopo.
. Sus masas atómicas son: 49.9472 u y 50.9490 u, respectivamente. Sabiendo que la masa atómica promedio del vanadio es 50.9415 u, calcula la abundancia relativa de cada isótopo.
-
Abundancia relativa de los isótopos del silicio (4086)
La masa atómica del silicio es 28.086 u y tiene tres isótopos cuyas masas isotópicas son: 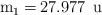 ,
, 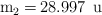 y
y 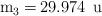 . La abundancia relativa del isótopo de masa
. La abundancia relativa del isótopo de masa 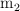 es
es 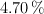 . Calcula las abundancias relativas de los otros isótopos.
. Calcula las abundancias relativas de los otros isótopos.
-
Verdadero o falso sobre isótopos (4011)
¿Cuál de estas dos proposiciones es verdadera? Explica por qué.
a) La masa atómica de un elemento toma el valor del isotopo natural mas abundante de ese elemento.
b) El isotopo de un elemento químico tiene el mismo número atómico del elemento, pero diferente masa atómica.
-
Abundancia relativa de los isótopos del nitrógeno (3474)
Calcula la abundancia relativa de los isótopos del nitrógeno si consideramos que sus masas isotópicas son nitrógeno-14 y nitrógeno-15 y la masa atómica del nitrógeno es 14.01 u.
 Isótopos
Isótopos