-
Molaridad, molalidad, normalidad y fracción molar de una disolución de ácido sulfúrico (5199)
Una solución de 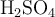 contiene 270 gramos de soluto por litro de disolución y una densidad de 1.32 g/mL. Determina la molaridad, molalidad, fracción molar y normalidad de la solución.
contiene 270 gramos de soluto por litro de disolución y una densidad de 1.32 g/mL. Determina la molaridad, molalidad, fracción molar y normalidad de la solución.
Datos: H = 1 ; S = 32 ; O = 16.
-
Molaridad, normalidad y molalidad de una disolución a partir de la densidad y el porcentaje (m/V) (5149)
Se quiere preparar 2 litros de una solución acuosa de ácido carbónico al 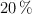 (m/V). Sabiendo que la densidad de la solución es de 1.6 g/mL, calcula la molaridad, molalidad y normalidad de la disolución.
(m/V). Sabiendo que la densidad de la solución es de 1.6 g/mL, calcula la molaridad, molalidad y normalidad de la disolución.
-
Descenso de la presión de vapor del disolvente al añadir un soluto (5119)
A temperatura muy próxima a 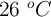 , la presión de vapor del agua resulta ser de 25.21 mm Hg. Calcula la presión de vapor a la misma temperatura de una solución de 2.32 molal de un compuesto no electrólitico y no volátil, suponiendo comportamiento ideal.
, la presión de vapor del agua resulta ser de 25.21 mm Hg. Calcula la presión de vapor a la misma temperatura de una solución de 2.32 molal de un compuesto no electrólitico y no volátil, suponiendo comportamiento ideal.
-
Porcentaje en masa y volumen, molaridad y partes por millón de un fertilizante (5075)
Algunos elementos como el Zn son considerados como micronutrientes del suelo y por tanto son suplementados en pequeñas cantidades en el sustrato. Se prepara una solución a partir de 2.476 g de 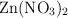 disueltos en 500 mL de agua. Determina la concentración de esta solución en
disueltos en 500 mL de agua. Determina la concentración de esta solución en 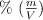 , M y ppm.
, M y ppm.
Datos: Zn = 65.4 ; N = 14 ; O = 16.
-
Molaridad de una disolución conocida su molalidad y su densidad (4970)
Calcula la molaridad de una disolución acuosa 1.52 m (molal) de 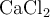 , sabiendo que la densidad de la solución es 1.129 g/mL.
, sabiendo que la densidad de la solución es 1.129 g/mL.
 Molalidad
Molalidad