-
Volumen final de un gas al variar su presión y temperatura
Un gas ocupa un volumen de 2 L en condiciones normales. ¿Qué volumen ocupará esta misma masa de gas a 2 atm y 50 ºC?
-
Presión en el interior de un neumático tras horas de rodaje
La parte interior de un neumático de automóvil está bajo una presión manométrica de 28 Pa a 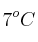 y con un volumen de 10 L de aire. Después de varias horas, la temperatura del aire interior sube a 320 K y su volumen aumenta un
y con un volumen de 10 L de aire. Después de varias horas, la temperatura del aire interior sube a 320 K y su volumen aumenta un 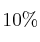 . ¿Cuál será la presión en el interior del neumático en ese momento?
. ¿Cuál será la presión en el interior del neumático en ese momento?
-
Presión a la que hay que someter un gas para comprimirlo hasta medio litro (3332)
¿A cuántas atmósferas de presión deben someterse 4 litros de gas neón, medido a 2 atmósferas y 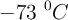 , para comprimirlo hasta medio litro, cuando la temperatura es
, para comprimirlo hasta medio litro, cuando la temperatura es 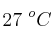 ?
?
-
Temperatura final de los gases en un cilindro tras la combustión
En el motor de un coche se comprime una mezcla de aire y gasolina en los cilindros antes de encenderse. En un motor típico se tiene una relación de compresión de 9 a 1, es decir, el gas en los cilindros se comprime a 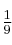 de su volumen original. La presión inicial de la mezcla es de 1 atm y la temperatura inicial es de
de su volumen original. La presión inicial de la mezcla es de 1 atm y la temperatura inicial es de 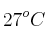 , si la presión después de la conversión es de 21.7 atm, ¿cuál es la temperatura del gas comprimido?
, si la presión después de la conversión es de 21.7 atm, ¿cuál es la temperatura del gas comprimido?
-
Ley general de los gases: burbuja que asciende (3105)
Se libera una burbuja de 25 mL del tanque de aire de un buzo que se encuentra a una presión de 4 atm y a una temperatura de 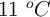 . ¿Cuál es el volumen de la burbuja cuando alcanza la superficie del océano, donde la presión es de 1 atm y la temperatura de
. ¿Cuál es el volumen de la burbuja cuando alcanza la superficie del océano, donde la presión es de 1 atm y la temperatura de 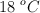 ?
?
 Ley general de los gases
Ley general de los gases