-
Concepto de mol aplicado a una mezcla de gases (151)
En un recipiente se introducen 0.60 g de hidrógeno y 0.10 moles de etano 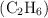 . Calcula:
. Calcula:
a) El número de moléculas de cada tipo que hay en el recipiente.
b) El número de átomos de hidrógeno.
c) Los moles que contiene el recipiente.
d) El volumen que ocupan si se miden en condiciones normales.
-
Moléculas de agua en un miligramo (134)
¿Cuántas moléculas de agua, 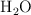 , hay en un copo que pesa 1 mg? (Pesos atómicos: O = 16, H = 1).
, hay en un copo que pesa 1 mg? (Pesos atómicos: O = 16, H = 1).
-
Moles, moléculas y átomos (114)
a) ¿Cuántos gramos son 1.5 moles de sacarosa, 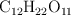 ?¿Cuántos moles de átomos de carbono contienen?
?¿Cuántos moles de átomos de carbono contienen?
b) Determina la masa, en kg, de 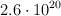 moléculas de
moléculas de 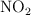 .
.
c) Indica el número de átomos de nitrógeno que hay en 0.76 g de 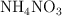 .
.
Datos: O = 16 ; C = 12 ; N = 14 ; H = 1.
-
Átomos de hidrógeno en una masa de sulfato de amonio (113)
Calcula el número de átomos de hidrógeno que hay en 36.9 g de sulfato de amonio 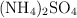 .
.
 Mol
Mol