-
Variación de entalpía y energía de reacción 0001
a) Calcula la variación de entalpía estándar correspondiente a la reacción:
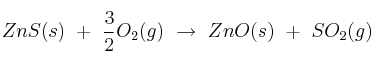
b) ¿Qué calor se absorbe o desprende , presión constante, cuando reaccionan 100 g de ZnS(s) con oxígeno en exceso?
Datos: ![\Delta H_f^0[ZnS(s)] = -202,9\ kJ/mol \Delta H_f^0[ZnS(s)] = -202,9\ kJ/mol](local/cache-TeX/3fd3201f80bdc01e15e15ca27fada880.png) ;
; ![\Delta H_f^0[ZnO(s)] = -348\ kJ/mol \Delta H_f^0[ZnO(s)] = -348\ kJ/mol](local/cache-TeX/b6fdead2c1454427ec936ca85df77e1f.png) ;
; ![\Delta H_f^0[SO_2(g)] = -296,1\ kJ/mol \Delta H_f^0[SO_2(g)] = -296,1\ kJ/mol](local/cache-TeX/741f3e5f894641bf511c52ba9f9a66fb.png) . Masas atómicas: S = 32 ; O = 16 ; Zn = 65,4.
. Masas atómicas: S = 32 ; O = 16 ; Zn = 65,4.
-
Termoquímica: Entalpía de formación y calor de combustión 0001
Las gasolinas se caracterizan por el octanaje, que equivale al porcentaje de n-octano que poseen. Sabiendo que la entalpía de reacción del n-octano es - 5450 kJ/mol y que la densidad de la gasolina de 95 es 680 g/L:
a) Determina el calor de formación del n-octano.
b) Calcula la energía que desprende la combustión de un litro de gasolina de 95.
Datos: ![\Delta H_f [CO_2(g)] = -393\ kJ/mol \Delta H_f [CO_2(g)] = -393\ kJ/mol](local/cache-TeX/516b44173c25df7e390dc8f8c23e0b7c.png) ;
; ![\Delta H_f [H_2O(l)] = -286\ kJ/mol \Delta H_f [H_2O(l)] = -286\ kJ/mol](local/cache-TeX/dff618ca9e23cfc4b6fbbeb841afd683.png)
-
Entalpía de formación y calor de reacción (1613)
El fosfuro de aluminio reacciona con agua para dar hidróxido de aluminio y fosfano, según la reacción:
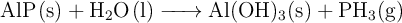
Determina la entalpía de reacción del proceso a partir de los siguientes datos, en 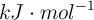 :
:
 ;
; ![\Delta H_f^0\ [\ce{Al(OH)3}] = -1\ 274.5 \Delta H_f^0\ [\ce{Al(OH)3}] = -1\ 274.5](local/cache-TeX/09f1b36cf988d51f654ae36e01358074.png) ;
; 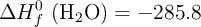 ;
; 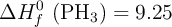 ; P = 31 ; Al = 27.
; P = 31 ; Al = 27.
Calcula la energía del sistema cuando reaccionan 20 g de 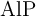 y decide si es energía liberada o absorbida por el sistema.
y decide si es energía liberada o absorbida por el sistema.
-
Problema entalpía de reacción 0014
Determina la 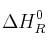 del proceso
del proceso 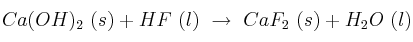 y calcula la energía intercambiada cuando se hacen reaccionar 850 mL de HF al 30% con exceso de
y calcula la energía intercambiada cuando se hacen reaccionar 850 mL de HF al 30% con exceso de 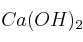 .
.
Datos: 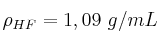 ; H = 1 ; F = 19 ;
; H = 1 ; F = 19 ; ![\Delta H_f^0 [Ca(OH)_2\ (s)] = -985,2\ kJ/mol \Delta H_f^0 [Ca(OH)_2\ (s)] = -985,2\ kJ/mol](local/cache-TeX/fb7345a61ec0a40a3d9ff26d3d0a013b.png) ;
; ![\Delta H_f^0 [CaF_2\ (s)] = -1228\ kJ/mol \Delta H_f^0 [CaF_2\ (s)] = -1228\ kJ/mol](local/cache-TeX/60487f0f7b9faee9c27e67b17fe97b6c.png) ;
; ![\Delta H_f^0 [HF\ (l)] = -299,8\ kJ/mol \Delta H_f^0 [HF\ (l)] = -299,8\ kJ/mol](local/cache-TeX/4dca7170db162c30cb4b7676facbd6a8.png) ;
; ![\Delta H_f^0 [H_2O\ (l)] = -285,8\ kJ/mol \Delta H_f^0 [H_2O\ (l)] = -285,8\ kJ/mol](local/cache-TeX/3bfecfcb62ca6612f17353c053eee191.png)
-
PAU entalpía 0005
La descomposición explosiva del trinitrotolueno 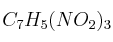 se puede expresar según:
se puede expresar según:
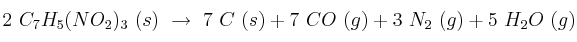
a) Halla la energía obtenida al descomponerse 1 kg de TNT.
b) Determina el volumen ocupado por los gases liberados en dicha descomposición, a presión atmosférica y a 500 ºC.
Datos: ![\Delta H^0_f[C_7H_5(NO_2)_3(s)] = -64,1\ kJ/mol \Delta H^0_f[C_7H_5(NO_2)_3(s)] = -64,1\ kJ/mol](local/cache-TeX/a98c721153dc3addc8105482e9a7138f.png) ;
; ![\Delta H^0_f[CO(g)] = -110,5\ kJ/mol \Delta H^0_f[CO(g)] = -110,5\ kJ/mol](local/cache-TeX/09ba8a60ad9cb82a43a37ba7bdeedb2a.png) ;
; ![\Delta H^0_f[H_2O(g)] = -241,8\ kJ/mol \Delta H^0_f[H_2O(g)] = -241,8\ kJ/mol](local/cache-TeX/121f649264d700ca0b3f070eca36e7dc.png) .
.
 Calor
Calor