-
Equilibrio ácido-base: Aplicación Le Chatelier 0001
a) Escribe el equilibrio de hidrólisis del ion amonio (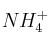 ), identificando en el mismo las especies que actúan como ácido o como base de Brönsted.
), identificando en el mismo las especies que actúan como ácido o como base de Brönsted.
b) Razona cómo variará la concentración de ion amonio al añadir una disolución de NaOH .
c) Razona cómo variará la concentración de ion amonio al añadir una disolución de HCl .
-
Aplicación Principio Le Chatelier 0001
Supón el siguiente sistema en equilibrio: 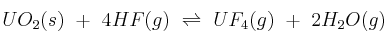 . Explica hacia dónde se desplaza el equilibrio cuando:
. Explica hacia dónde se desplaza el equilibrio cuando:
a) Se adiciona 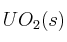 al sistema.
al sistema.
b) Se elimina HF(g).
c) Se aumenta la capacidad del recipiente de reacción.
-
Constante de equilibrio y Principio de Le Chatelier 0003
La descomposición del pentaóxido de dinitrógeno se puede describir como: 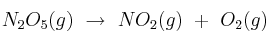
a) Escribe las expresiones de  y
y  .
.
b) ¿Explica cómo evoluciona el equilibrio si se aumenta la presión del sistema?
c) ¿Cómo afectaría al equilibrio un aumento de la concentración de oxígeno? ¿Y al valor de  ?
?
-
Principio de Le Chatelier: factores que afectan al equilibrio químico (1623)
Para la siguiente reacción exotérmica en el equilibrio:
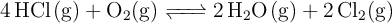
Razona cuál es el efecto sobre la concentración de HCl en el equilibrio en los siguientes casos:
a) Aumento de la concentración de 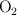
b) Disminución de la concentración de 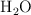
c) Aumento del volumen del sistema.
d) Reducción de la temperatura del sistema.
e) Añadir un gas inerte como He.
f) Introducir un catalizador positivo.
-
Constante de equilibrio y Principio de Le Chatelier 0002
En un matraz de 20 L, a 25 ºC, se encuentran en equilibrio 2,14 moles de 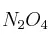 y 0,50 moles de
y 0,50 moles de 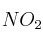 según:
según: 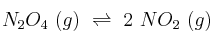
a) Calcule el valor de las constantes 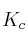 y
y 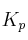 a esa temperatura.
a esa temperatura.
b) ¿Cuál es la concentración de 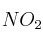 cuando se restablece el equilibrio después de introducir dos moles adicionales de
cuando se restablece el equilibrio después de introducir dos moles adicionales de 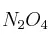 , a la misma temperatura?
, a la misma temperatura?
Dato: R = 0,082 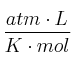
 Le Chatelier
Le Chatelier