-
Cuestiones sobre disoluciones (3088)
Decide si cada una de las proposiciones son verdaderas o falsas y explica por qué:
1) El peso de un equivalente gramo de hidróxido de aluminio es igual a la masa de un mol del mismo hidróxido.
2) A partir de una disolución diluida se puede preparar una disolución de mayor concentración por medio de la evaporación.
3) Una forma de economizar reactivos en el laboratorio es utilizando la concentración de los reactivos en partes por millón.
4) Para determinar la molaridad de una disolución es necesario conocer la cantidad de disolvente presente en dicha disolución.
5) Para determinar la concentración de la mezcla de dos disoluciones del mismo compuesto y diferentes concentraciones basta con promediar las mezclas de las mismas.
-
Separación de componentes de una mezcla (2895)
El benceno y la piridina son líquidos a temperatura ambiente y se mezclan perfectamente entre sí, pero son inmiscibles con agua. Si mezclamos los tres líquidos, ¿cómo podríamos separarlos? Explica y describe cómo llevarías a cabo esa separación.
(Puntos de ebullición: benceno = 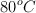 ; piridina =
; piridina = 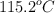 ; agua =
; agua = 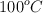 ).
).
-
Estequiometría en reacción de neutralización (2689)
En un recipiente se mezclaron 300 mL de disolución de ácido bromhídrico (HBr) 0.25 M con 750 mL de disolución 0.1 M de hidróxido de potasio (KOH). Los gramos de bromuro de potasio (KBr) (M=119 u) obtenidos en la mezcla fueron:
a) 0.46 g
b) 4.6 g
c) 8.9 g
d) 0.89 g
-
Presión osmótica y masa molecular de un compuesto (2622)
Una disolución de 2.04 g de hemoglobina en 100 mL de disolución tiene una presión osmótica igual a 5.83 mm Hg, a 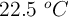 . ¿Cuál es la masa molecular de la hemoglobina?
. ¿Cuál es la masa molecular de la hemoglobina?
-
Molaridad a partir de concentración en % (m/V) (2614)
Calcula la molaridad de una disolución de ácido sulfuroso cuya concentración es 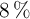 (m/V).
(m/V).
 Disoluciones
Disoluciones