-
Molaridad de una disolución final tras dilución de otra de CaCl2 (6455)
Se prepara una disolución de 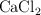 disolviendo 8.5 g de la sal en agua y diluyendo a 100 mL. De esta solución se toman 10 mL y se diluyen a 50 mL con agua destilada. Calcula la concentración molar del catión calcio y el anión cloruro antes y después de la dilución.
disolviendo 8.5 g de la sal en agua y diluyendo a 100 mL. De esta solución se toman 10 mL y se diluyen a 50 mL con agua destilada. Calcula la concentración molar del catión calcio y el anión cloruro antes y después de la dilución.
Masas atómicas: Ca = 40 ; Cl = 35.5
-
Repaso: moles y estequiometría de la combustión del decano (6384)
En la combustión completa del hidrocarburo 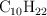 se produce dióxido de carbono y agua. La combustión del decano se representa mediante la siguiente reacción:
se produce dióxido de carbono y agua. La combustión del decano se representa mediante la siguiente reacción:

Si un recipiente contenía 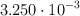 moles de decano y se hacen reaccionar:
moles de decano y se hacen reaccionar:
a) ¿Cuántos moles de 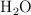 se producen?
se producen?
b) ¿Cuántos moles de  se necesitan?
se necesitan?
-
Fórmula molecular de un compuesto desconocido y resultado de su combustión (6361)
Se tiene en una botella una sustancia orgánica desconocida, de la que se sabe que su concentración es de 0.250 M. Se toman 200 mL de esa botella y se destila completamente, obteniéndose un líquido puro que pesa 4.3 g. La composición centesimal de ese líquido es de 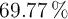 de C,
de C, 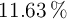 de H y el resto de oxígeno.
de H y el resto de oxígeno.
a) Calcula su fórmula molecular.
b) Si se quema completamente, calcula el volumen de dióxido de carbono, medido a 1 atm y 300 K, que se produce.
c) Calcula la entalpía de combustión, sabiendo que la entalpía de formación del vapor de agua es 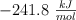 y la del dióxido de carbono es
y la del dióxido de carbono es 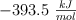 .
.
d) Dibuja una posible estructura de la molécula y escribe su nombre.
-
Masa de óxido de plata que se obtiene al oxidar plata metálica (6315)
El óxido de plata tiene un valor en el mercado superior a la plata natural. Para obtenerlo se hace reaccionar la plata con un compuesto con hidroxilo, dando lugar al óxido de plata y agua. Si hacemos reaccionar 2.353 kg de plata con 431 kg de ion hidroxilo, ¿qué cantidad de óxido de plata obtendré de dicha reacción?
Masas atómicas: Ag = 107.8 ; H = 1 ; O = 16.
-
Estequiometría de la reacción de combustión del estireno (6249)
¿Cuántos moles de  y
y 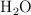 se producirán mediante combustión de 0.010 mol de estireno?
se producirán mediante combustión de 0.010 mol de estireno?
 Ajuste
Ajuste