-
Diagrama entálpico: endotérmica o exotérmica (1857)
Dada la reacción:

a) Dibuja el diagrama de entalpía teniendo en cuenta que las energías de activación para la reacción directa e inversa son 134 kJ/mol y 360 kJ/mol.
b) Justifica si la reacción directa es exotérmica o endotérmica.
-
Entalpías de formación, reacción y enlace 0001
La reacción de hidrogenación del buta-1,3-dieno para dar butano es 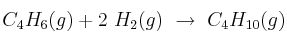 . Calcula la entalpía de la reacción a 25 ºC y en condiciones estándar:
. Calcula la entalpía de la reacción a 25 ºC y en condiciones estándar:
a) A partir de la entalpía de formación del agua y de las entalpías de combustión del buta-1,3-dieno y del butano.
b) A partir de las entalpías de enlace.
Datos: ![\Delta H_C^0[C_4H_6(g)] = -2540,2\ kJ/mol \Delta H_C^0[C_4H_6(g)] = -2540,2\ kJ/mol](local/cache-TeX/8def700d5e629e0012f77d6d53d85868.png) ;
; ![\Delta H_C^0[C_4H_{10}(g)] = -2877,6\ kJ/mol \Delta H_C^0[C_4H_{10}(g)] = -2877,6\ kJ/mol](local/cache-TeX/7c3b4856f15a580f055b64f06c3d1aad.png) ;
; ![\Delta H_f^0[H_2O(l)] = -285,6\ kJ/mol \Delta H_f^0[H_2O(l)] = -285,6\ kJ/mol](local/cache-TeX/ab792c53203f068d97f6bbb9308c00b3.png) . Entalpías de enlace (kJ/mol): (C-C) = 348,2 ; (C=C) = 612,9 ; (C-H) = 415,3 ; (H-H) = 436,4.
. Entalpías de enlace (kJ/mol): (C-C) = 348,2 ; (C=C) = 612,9 ; (C-H) = 415,3 ; (H-H) = 436,4.
-
Termoquímica: Entalpía de formación y calor de combustión 0001
Las gasolinas se caracterizan por el octanaje, que equivale al porcentaje de n-octano que poseen. Sabiendo que la entalpía de reacción del n-octano es - 5450 kJ/mol y que la densidad de la gasolina de 95 es 680 g/L:
a) Determina el calor de formación del n-octano.
b) Calcula la energía que desprende la combustión de un litro de gasolina de 95.
Datos: ![\Delta H_f [CO_2(g)] = -393\ kJ/mol \Delta H_f [CO_2(g)] = -393\ kJ/mol](local/cache-TeX/516b44173c25df7e390dc8f8c23e0b7c.png) ;
; ![\Delta H_f [H_2O(l)] = -286\ kJ/mol \Delta H_f [H_2O(l)] = -286\ kJ/mol](local/cache-TeX/dff618ca9e23cfc4b6fbbeb841afd683.png)
-
Entalpía de formación y calor de reacción (1613)
El fosfuro de aluminio reacciona con agua para dar hidróxido de aluminio y fosfano, según la reacción:
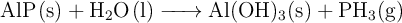
Determina la entalpía de reacción del proceso a partir de los siguientes datos, en 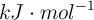 :
:
 ;
; ![\Delta H_f^0\ [\ce{Al(OH)3}] = -1\ 274.5 \Delta H_f^0\ [\ce{Al(OH)3}] = -1\ 274.5](local/cache-TeX/09f1b36cf988d51f654ae36e01358074.png) ;
; 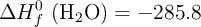 ;
; 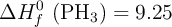 ; P = 31 ; Al = 27.
; P = 31 ; Al = 27.
Calcula la energía del sistema cuando reaccionan 20 g de 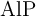 y decide si es energía liberada o absorbida por el sistema.
y decide si es energía liberada o absorbida por el sistema.
-
EBAU Andalucía: química (septiembre 2010) - ejercicio B.5 (1481)
Considera la reacción de hidrogenación del propino:
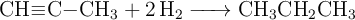
a) Calcula la entalpía de la reacción, a partir de las entalpías medias de enlace.
b) Determina la cantidad de energía que habrá que proporcionar a 100 g de hidrógeno molecular para disociarlo completamente en sus átomos.
Datos: Entalpías de enlace en kJ/mol: (C−C) = 347; (C≡C) = 830; (C−H) = 415; (H−H) = 436.
Masa atómica: H = 1.
 Entalpía
Entalpía