-
Reducción del óxido de cromo(III) (2857)
La reducción del 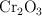 por el
por el 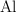 se realiza provocando la ignición de una mezcla adecuada y la reacción química es:
se realiza provocando la ignición de una mezcla adecuada y la reacción química es:

a) Ajusta la reacción.
b) ¿Cuántos gramos de cromo se obtienen con 250 g de 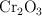 ?
?
Masas atómicas: Al = 27 ; Cr = 52 ; O = 16
-
Estequiometría y reactivo limitante en formación de urea (2854)
Según la reacción 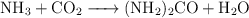 , hacemos reaccionar 500 g de amoniaco,
, hacemos reaccionar 500 g de amoniaco, 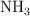 , con 750 g de
, con 750 g de  , para obtener urea.
, para obtener urea.
a) ¿Cuál de los dos es el reactivo limitante?
b) ¿Cuántos gramos de urea se obtienen supuesto un rendimiento del 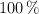 ?
?
-
Reacción química: ajuste, reactivo limitante y estequiometría (2853)
Disponemos, en un matraz, de 60 g de HCl a los que añadimos 30 g de 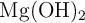 , produciéndose la siguiente reacción:
, produciéndose la siguiente reacción:
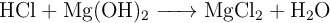
a) Ajusta la reacción.
b) ¿Qué reactivo se encuentra en exceso?
c) ¿Cuántos gramos de dicho reactivo permanecerán sin reaccionar al final del proceso?
d) ¿Cuántos gramos de 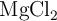 se producirán?
se producirán?
Masas atómicas: H = 1 ; Cl = 35.5 ; Mg = 24.3 ; O = 16
-
Estequiometría de una reacción química 0002
Dada la ecuación química:
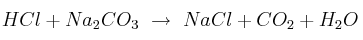
a) Ajusta la ecuación.
b) ¿Qué cantidad de HCl será necesaria para reaccionar completamente con 52 g de 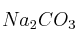 ?
?
c) ¿Qué cantidad de NaCl se formará?
Masas atómicas: Na = 23 ; Cl = 35,5 ; C = 12 ; O = 16 ; H =1
-
Estequiometría en la formación del amoniaco (2768)
En el proceso de formación del amoniaco, el 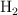 reacciona con el
reacciona con el 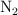 y produce
y produce 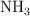 , a 400 grados centígrados y 630 torr. Calcula los moles de amoniaco que se producen al reaccionar 13.6 g de nitrógeno.
, a 400 grados centígrados y 630 torr. Calcula los moles de amoniaco que se producen al reaccionar 13.6 g de nitrógeno.
 Mol
Mol