-
Termoquímica: Entalpía de reacción y energías de enlace (1481)
Considera la reacción de hidrogenación del propino:
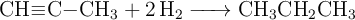
a) Calcula la entalpía de la reacción, a partir de las entalpías medias de enlace.
b) Determina la cantidad de energía que habrá que proporcionar a 100 g de hidrógeno molecular para disociarlo completamente en sus átomos.
Datos: Entalpías de enlace en kJ/mol: (C−C) = 347; (C≡C) = 830; (C−H) = 415; (H−H) = 436.
Masa atómica: H = 1.
-
EBAU Andalucía: química (junio 2010) - ejercicio B.6 (1045)
Para la reacción:
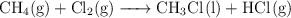
a) Calcula la entalpía de reacción estándar a  , a partir de las entalpías de enlace y de las entalpías de formación en las mismas condiciones de presión y temperatura.
, a partir de las entalpías de enlace y de las entalpías de formación en las mismas condiciones de presión y temperatura.
b) Sabiendo que el valor de 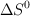 de la reacción es
de la reacción es 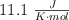 y utilizando el valor de
y utilizando el valor de 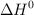 de la reacción obtenido a partir de los valores de las entalpías de formación, calcula el valor de
de la reacción obtenido a partir de los valores de las entalpías de formación, calcula el valor de 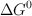 , a
, a  .
.
Datos: ![\Delta \ce{H_f^0[CH4(g)] = -74.8\ kJ/mol} \Delta \ce{H_f^0[CH4(g)] = -74.8\ kJ/mol}](local/cache-TeX/5a2baa76f1d353a3e96bf7eb166e82a8.png) ;
; ![\Delta \ce{H_f^0[CH3Cl(l)] = -82.0\ kJ/mol} \Delta \ce{H_f^0[CH3Cl(l)] = -82.0\ kJ/mol}](local/cache-TeX/ed5dbe6eed378fba7f6d6fb0a4219d10.png) ;
; ![\Delta \ce{H_f^0[HCl(g)] = -92.3\ kJ/mol} \Delta \ce{H_f^0[HCl(g)] = -92.3\ kJ/mol}](local/cache-TeX/08912cb4d9ce6868824a9dc378ece2e7.png) . Entalpías de enlace en kJ/mol: (C-H) = 414 ; (Cl-Cl) = 243 ; (C-Cl) = 339 ; (H-Cl) = 432.
. Entalpías de enlace en kJ/mol: (C-H) = 414 ; (Cl-Cl) = 243 ; (C-Cl) = 339 ; (H-Cl) = 432.
-
Energía de enlace del hidrógeno en la reacción de formación del amoniaco (459)
Sabiendo que 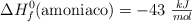 y las energías de enlace
y las energías de enlace 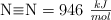 y
y 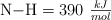 , determina la energía de enlace
, determina la energía de enlace 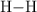 .
.
-
Entalpía de reacción a partir de las energías de enlace (458)
Calcula la variación de entalpía para la siguiente reacción:
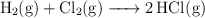
Sabiendo que las energías de enlace son: 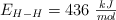 ,
, 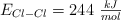 y
y 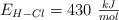 .
.
-
Entalpía de formación del agua a partir de las energía de enlace (457)
Calcula la entalpía de formación del agua sabiendo que las energías de enlace son las siguientes: H-H (436 kJ/mol); O=O (494 kJ/mol); H-O (460 kJ/mol).
 Energía de enlace
Energía de enlace