-
Cinética de la descomposición de la urea en medio ácido (6009)
La urea (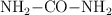 ) es el producto final del metabolismo de las proteínas de los animales. La urea se descompone en medio ácido según la reacción:
) es el producto final del metabolismo de las proteínas de los animales. La urea se descompone en medio ácido según la reacción:
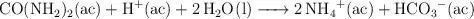
Esta reacción es de primer orden respecto a la urea y su velocidad no depende de otros reactivos. Cuando la concentración de urea es de 0.200 M, la velocidad de la reacción a 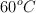 es
es 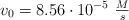 .
.
a) ¿Cuál es el valor de la constante de velocidad a esta temperatura?
b) Si la concentración inicial de urea es 0.500 M, ¿cuál sería su concentración después de 1 hora?
c) ¿Cuál es la vida media de la urea a 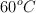 ?
?
-
Constante de velocidad de una reacción de segundo orden (5902)
Una reacción hipotética que convierte el reactivo A en producto P es de orden 2 respecto al reactivo. Si se parte de una concentración de A igual a 0.123 M y se determina que al cabo de 10 minutos la concentración de A es de 0.090 M, determina:
a) El valor de la constante de velocidad.
b) La concentración de A después de transcurridos 60 s.
-
Cinética química: velocidad de la formación de KOH sabiendo la del oxígeno (5750)
El superóxido de potasio (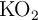 ) se emplea en máscaras de respiración para generar oxígeno según la reacción:
) se emplea en máscaras de respiración para generar oxígeno según la reacción:

Si en un instante determinado el superóxido de potasio va reaccionando a la velocidad de 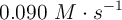 , ¿cuál es la velocidad a la que se estará formando el hidróxido de potasio?
, ¿cuál es la velocidad a la que se estará formando el hidróxido de potasio?
-
Órdenes parciales de reacción y tipo de reacción (5092)
Los siguientes datos de velocidad inicial fueron obtenidos para la reacción:
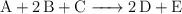
![\begin{tabular}{|c|c|c|c|c|}
\hline Experimento&[A]_0\ (M)&[B]_0\ (M)&[C]_0\ (M)&r_i\ (M\cdot s^{-1})\\
\hline 1&1.20&1.20&1.00&r_1\\
\hline 2&0.60&1.20&1.00&r_2 = \frac{r_1}{2}\\
\hline 3&0.60&0.60&1.00&r_3 = \frac{r_2}{4}\\
\hline 4&1.20&1.20&0.50&r_4 = 16r_3\\
\hline 5&0.60&0.60&0.50&r_5\\
\hline
\end{tabular} \begin{tabular}{|c|c|c|c|c|}
\hline Experimento&[A]_0\ (M)&[B]_0\ (M)&[C]_0\ (M)&r_i\ (M\cdot s^{-1})\\
\hline 1&1.20&1.20&1.00&r_1\\
\hline 2&0.60&1.20&1.00&r_2 = \frac{r_1}{2}\\
\hline 3&0.60&0.60&1.00&r_3 = \frac{r_2}{4}\\
\hline 4&1.20&1.20&0.50&r_4 = 16r_3\\
\hline 5&0.60&0.60&0.50&r_5\\
\hline
\end{tabular}](local/cache-TeX/bb1e2cd830b5351276c0a72627ce770d.png)
a) ¿Cuáles son los órdenes de reacción con respecto a los reactivos A, B y C?
b) ¿Cuál es el valor de 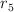 en términos de
en términos de 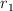 ?
?
c) ¿Es una reacción elemental? Justifica tu respuesta.
-
Presión total de un sistema gaseoso después de una hora (4811)
El reactivo A se descompone según la reacción: 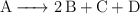 , siendo una reacción homogénena en fase gaseosa. Se tiene un mol de A en un recipiente de 2 L a
, siendo una reacción homogénena en fase gaseosa. Se tiene un mol de A en un recipiente de 2 L a 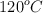 . Halla la presión total del recipiente al cabo de una hora a partir de los datos de la tabla siguiente:
. Halla la presión total del recipiente al cabo de una hora a partir de los datos de la tabla siguiente:

 Velocidad reacción
Velocidad reacción