-
Electrodeposición: masa de metal e intensidad de corriente (2225)
¿Qué intensidad debe tener una corriente para que deposite 60 gramos de calcio (40.0 u) en una hora y media?
-
Masa de metal depositado en cuba electrolítica 0001
¿Cuánto tiempo será necesario para que se el depositen 12 g de aluminio, si hacemos pasar una corriente de 10 A?
-
Electroquímica: electrodeposición y estequiometría 0001
Al pasar una corriente eléctrica por una disolución acuosa de nitrato de cobalto(II) se desprende oxígeno en el ánodo y se deposita cobalto en el cátodo. Calcula:
a) La intensidad de la corriente que se necesita para depositar 8,42 g de Co de una disolución acuosa de 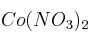 en 35 minutos.
en 35 minutos.
b) El volumen de oxígeno gaseoso, medido en condiciones normales, que se desprende en el ánodo.
Datos: F = 96500 C. Masas atómicas: N = 14; O = 16; Co = 59
-
Ley de Faraday y esquiometría 0001
Al hacer la electrolisis del cloruro de sodio, se depositan 12 g de sodio en el cátodo. Calcula:
a) Los moles de cloro gaseoso liberados en el ánodo.
b) El volumen que ocupa el cloro del apartado anterior a 700 mm de Hg y 100 ºC.
Masas atómicas: Na = 23; Cl = 35,5
-
Electroquímica: aplicación de la ley de Faraday (1750)
En el cátodo de una cuba electrolítica se reduce la especie dicromato a catión 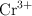 , en medio ácido. Calcula:
, en medio ácido. Calcula:
a) ¿Cuántos moles de electrones deben llegar al cátodo para reducir un mol de dicromato?
b) Para reducir toda la especie dicromato presente en 20 mL de disolución, se requiere una corriente eléctrica de 2.2 amperios durante 15 minutos. Calcula la carga que se consume, expresada en Faraday, y deduce cuál será la concentración inicial de dicromato.
Dato: F = 96 500 C.
 Faraday
Faraday