-
Masa de KCl necesaria y porcentaje en masa de una disolución molal (6704)
Se desea preparar una solucion 0.600 molal de 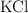 .
.
a) Calcula la cantidad de 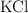 que debe agregarse a 250 g de solvente para tal propósito.
que debe agregarse a 250 g de solvente para tal propósito.
b) Expresa la concentración en 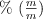 de la disolución.
de la disolución.
-
Molaridad y molalidad finales después de diluir una disolución (6483)
Calcula la molaridad y molalidad, así como el volumen de disolución preparada que contiene 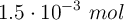 de soluto de la disolución acuosa a
de soluto de la disolución acuosa a 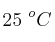 :
:
a) 100 mg de una disolución 2.5 m de cloruro de hidrógeno se diluyen con agua hasta obtener un volumen final de 1.50 L.
b) 20 mL de una disolución 1.0 M de amoniaco se diluyen con agua hasta obtener un volumen final de 1.00 L
-
Porcentaje en masa, molaridad y molalidad de una disolución de urea
Se prepara una disolución disolviendo 55 g de urea (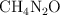 ) en 950 g de agua. Se sabe que la densidad de esta disolución es de
) en 950 g de agua. Se sabe que la densidad de esta disolución es de 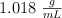 . Expresa la concentración de la disolución de urea en:
. Expresa la concentración de la disolución de urea en:
a) Porcentaje en masa.
b) Molaridad.
c) Molalidad.
-
Molalidad de una solución sabiendo la masa de soluto y la de solución
Determina la concentracion molal de una solución de 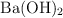 sabiendo que la masa de soluto es 180 g y se diluye en 3 kg de solución.
sabiendo que la masa de soluto es 180 g y se diluye en 3 kg de solución.
Masas atómicas: Ba = 137 ; O = 16 ; H = 1.
-
Molalidad y porcentaje en masa de una solución saturada de urea
A 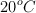 la solubilidad de la urea
la solubilidad de la urea 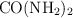 es de
es de 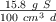 . Averigua:
. Averigua:
a) La molalidad de la solución saturada, sabiendo que la densidad del etanol a 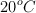 es
es 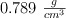 .
.
b) El porcentaje en peso 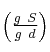 y el porcentaje en peso
y el porcentaje en peso 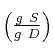 .
.
Masas atómicas: H = 1 ; C = 12 ; N = 14 ; O = 16.
(Recuerda que S es soluto, d es disolvente y D es disolución).
 Molalidad
Molalidad