-
Masa molecular de un compuesto a partir del aumento ebulloscópico en su disolución (6012)
Se prepara una disolución disolviendo 1.50 g de un compuesto en 25.0 mL de agua a  . El punto de ebullición de esta disolución es de
. El punto de ebullición de esta disolución es de 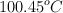 .
.
a) ¿Cuál será la masa molar del compuesto si es un no electrolito no volátil y la disolución se comporta de forma ideal?
b) Mediciones de conductividad de la disolución estudiada indican que el compuesto en realidad es iónico con fórmula general 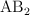 o
o 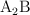 (siendo A un catión y B un anión). ¿Cuál sería entonces la masa molar del compuesto si la disolución se comporta idealmente?
(siendo A un catión y B un anión). ¿Cuál sería entonces la masa molar del compuesto si la disolución se comporta idealmente?
c) El análisis de la composición indica una fórmula empírica de 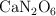 . Explica la diferencia entre la masa de la fórmula real y la calculada a partir del experimento de aumento ebulloscópico.
. Explica la diferencia entre la masa de la fórmula real y la calculada a partir del experimento de aumento ebulloscópico.
Datos: 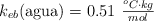 ;
; 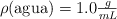
-
Puntos de ebullición y fusión de una disolución etanólica de KCl
Determine el punto de ebullición y de congelación en una disolución etanólica que contiene 4.8 g de cloruro de potasio, disociados completamente en 120 mL de etanol, con una pureza del 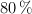 y densidad
y densidad 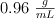 .
.
Datos: K = 39 ; Cl = 35.5 ; 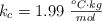 ;
; 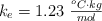 ;
; 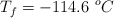 ;
; 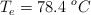
-
Punto de ebullición del disolvente conociendo la temperatura de ebullición de una disolución de urea
La urea es un compuesto que se utiliza como fuente de nitrógeno para las plantas. Se estima que un 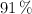 de lo producido a nivel mundial se direcciona a ser fertilizante. Si disolvemos 12 g de urea
de lo producido a nivel mundial se direcciona a ser fertilizante. Si disolvemos 12 g de urea 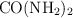 en 100 g de disolvente, la temperatura a la que ebulle es
en 100 g de disolvente, la temperatura a la que ebulle es 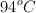 . Determina el punto de ebullición del disolvente puro si la constante ebulloscópica es
. Determina el punto de ebullición del disolvente puro si la constante ebulloscópica es 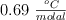 .
.
Masas atómicas: C = 12 ; N = 14 ; H = 1 ; O = 16.
-
Variación de los puntos de fusión y ebullición del agua cuando se mezcla con glicerina (5167)
Una solución acuosa tiene una densidad de 1.05 g/mL y contiene 0.200 kg de glicerina (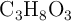 ) disueltos en 800 g de agua, a 1 atm de presión. ¿Cuál es el intervalo de temperatura en el que la solución se mantiene líquida?
) disueltos en 800 g de agua, a 1 atm de presión. ¿Cuál es el intervalo de temperatura en el que la solución se mantiene líquida?
Datos: 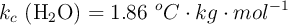 ;
; 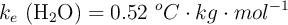
-
Presión de vapor y aumento ebulloscópico en una disolución (4370)
Los solutos afectan algunas propiedades físicas de las disoluciones. Explica por qué un soluto puede a la vez disminuir la presión de vapor del disolvente y aumentar su punto de ebullición.
 Aumento ebulloscópico
Aumento ebulloscópico