-
Fórmula molecular de un compuesto que se quema y se vaporiza (6521)
Por combustión de 0.5 g de una sustancia formada por C, H y O se obtuvieron 0.69 g de  y 0.56 g de
y 0.56 g de 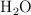 . Al vaporizar 1.6 g de esta sustancia se obtuvieron
. Al vaporizar 1.6 g de esta sustancia se obtuvieron 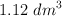 de vapor en condiciones normales de P y T. Halla la fórmula molecular de la sustancia.
de vapor en condiciones normales de P y T. Halla la fórmula molecular de la sustancia.
-
Repaso: fórmula molecular de un alcohol a partir de su composición centesimal (5872)
Un alcohol contiene 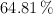 en masa de C,
en masa de C, 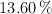 de H y
de H y 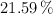 de O. Otro experimento muestra que su peso fórmula es aproximadamente 74 u. ¿Cuál es la fórmula molecular del alcohol?
de O. Otro experimento muestra que su peso fórmula es aproximadamente 74 u. ¿Cuál es la fórmula molecular del alcohol?
Masas atómicas: C = 12 ; H = 1 ; O = 16.
-
Repaso: fórmula molecular a partir de la composición centesimal (5871)
Un compuesto orgánico de masa molar 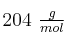 contiene un
contiene un 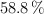 de C,
de C, 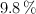 de H y
de H y 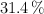 de O. Determina la fórmula molecular del compuesto.
de O. Determina la fórmula molecular del compuesto.
Masas atómica: C = 12 ; H = 1 ; O = 16.
-
Fórmula molecular de un hidrocarburo insaturado (4962)
Calcula la fórmula molecular de un compuesto orgánico cuya composición centesimal es de un 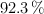 de C y un
de C y un 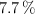 de H, sabiendo que 2.2 g de vapor de ese compuesto ocupan un volumen de 628 mL, a
de H, sabiendo que 2.2 g de vapor de ese compuesto ocupan un volumen de 628 mL, a 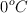 y 1 atm de presión.
y 1 atm de presión.
-
Fórmula empírica y molecular del DDT (4832)
El insecticida DDT contiene únicamente C, H y Cl. Cuando se quema una muestra de 1.5 g con oxígeno se obtienen 2.61 g dióxido de carbono y 0.343 g de agua, ¿cuál es la fórmula empírica del DDT? Si los 1.5 g de muestra, a 730 mm Hg y 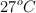 , ocupan
, ocupan 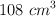 , ¿cuál es su fórmula molecular?
, ¿cuál es su fórmula molecular?
 Fórmula molecular
Fórmula molecular