-
Moles de oxígeno para modificar la concentración de producto en un equilibrio (5331)
En un recipiente de 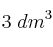 hay inicialmente 2 moles de dióxido de azufre gaseoso y 1 mol de trióxido de azufre gaseoso, a 700 K. Si se desea aumentar la concentración de trióxido de azufre hasta que llegue a 0.6 M:
hay inicialmente 2 moles de dióxido de azufre gaseoso y 1 mol de trióxido de azufre gaseoso, a 700 K. Si se desea aumentar la concentración de trióxido de azufre hasta que llegue a 0.6 M:
a) ¿Cuántos moles de oxígeno habrá que agregar al recipiente?
Considera el equilibrio y la constante  :
:
![\ce{SO2(g) + \textstyle{1\over 2}O2 (g) -> SO3(g)}\ \ [\ce{K_C = 18.9}] \ce{SO2(g) + \textstyle{1\over 2}O2 (g) -> SO3(g)}\ \ [\ce{K_C = 18.9}]](local/cache-TeX/b9b1e4c5bdf05810e5ce20c78100ce38.png)
-
EBAU Andalucía: química (junio 2022) - ejercicio B.6 (7929)
El hidróxido de cobre(II), 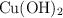 , es una sal muy poco soluble en agua.
, es una sal muy poco soluble en agua.
a) Escribe su equilibrio de solubilidad.
b) Expresa 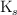 en función de la solubilidad.
en función de la solubilidad.
c) Razona cómo afectará al equilibrio la adición de 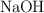 .
.
-
EBAU Madrid: química (junio 2022) pregunta B.3 (7653)
El compuesto 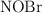 se descompone según la reacción:
se descompone según la reacción:
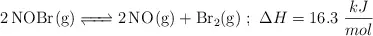
En un matraz de 1.0 L se introducen 2.0 mol de 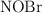 . Cuando se alcanza el equilibrio, a
. Cuando se alcanza el equilibrio, a  , se observa que se han formado 0.050 mol de
, se observa que se han formado 0.050 mol de 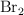 . Calcula:
. Calcula:
a) Las concentraciones de cada especie en el equilibrio.
b)  y
y  .
.
c) La presión total.
d) Justifica dos formas de favorecer la descomposición del 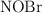 .
.
Dato: 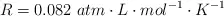
-
Principio de Le Chatelier aplicado a un equilibrio entre gases (7515)
Para el siguiente equilibrio explica cómo afectarán un aumento de la presión, un aumento de la temperatura y la presencia de un catalizador:
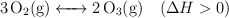
-
EBAU Andalucía: química (junio 2021) pregunta B.2 (7253)
Dada la reacción a  y 1 atm de presión
y 1 atm de presión 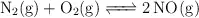 ;
; 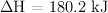 , razona si son verdaderas o falsas las siguientes afirmaciones:
, razona si son verdaderas o falsas las siguientes afirmaciones:
a) La constante de equilibrio  se duplica si se duplica la presión.
se duplica si se duplica la presión.
b) El sentido de la reacción se favorece hacia la izquierda si se aumenta la temperatura.
c) El valor de la constante de equilibrio para este proceso depende del catalizador utilizado.
 Le Chatelier
Le Chatelier