-
Concentración al cabo de un tiempo para una reacción de segundo orden (6482)
Si el tiempo de vida media de una reacción de segundo orden es 60.0 s, y la concentración inicial es 0.800 M, ¿cuál era la concentración a los 20.0 s?
-
Concentración conocido su orden de reacción y tiempo de semirreacción (6481)
Si el tiempo de vida media de una reacción de primer orden es 25.0 s, ¿cuál era la concentración cuando habían transcurrido 8.00 s si la concentración inicial era de 0.500 M?
-
Energía de activación de una reacción de orden uno y constante de velocidad (6164)
Para la reacción irreversible de primer orden:
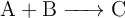
se sabe que la velocidad se hace cuatro veces mayor cuando aumenta la temperatura de 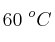 a
a 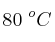 . Teniendo en cuenta que la constante de velocidad a
. Teniendo en cuenta que la constante de velocidad a 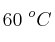 para dicha reacción es
para dicha reacción es 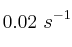 , determina:
, determina:
a) La energía de activación de la reacción (expresada en kJ/mol).
b) La constante de velocidad cuando la reacción se lleva a cabo a 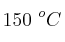 .
.
-
Cinética de la descomposición de la urea en medio ácido (6009)
La urea (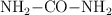 ) es el producto final del metabolismo de las proteínas de los animales. La urea se descompone en medio ácido según la reacción:
) es el producto final del metabolismo de las proteínas de los animales. La urea se descompone en medio ácido según la reacción:
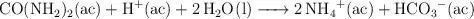
Esta reacción es de primer orden respecto a la urea y su velocidad no depende de otros reactivos. Cuando la concentración de urea es de 0.200 M, la velocidad de la reacción a 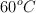 es
es 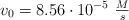 .
.
a) ¿Cuál es el valor de la constante de velocidad a esta temperatura?
b) Si la concentración inicial de urea es 0.500 M, ¿cuál sería su concentración después de 1 hora?
c) ¿Cuál es la vida media de la urea a 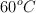 ?
?
-
Órdenes parciales de reacción y tipo de reacción (5092)
Los siguientes datos de velocidad inicial fueron obtenidos para la reacción:
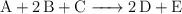
![\begin{tabular}{|c|c|c|c|c|}
\hline Experimento&[A]_0\ (M)&[B]_0\ (M)&[C]_0\ (M)&r_i\ (M\cdot s^{-1})\\
\hline 1&1.20&1.20&1.00&r_1\\
\hline 2&0.60&1.20&1.00&r_2 = \frac{r_1}{2}\\
\hline 3&0.60&0.60&1.00&r_3 = \frac{r_2}{4}\\
\hline 4&1.20&1.20&0.50&r_4 = 16r_3\\
\hline 5&0.60&0.60&0.50&r_5\\
\hline
\end{tabular} \begin{tabular}{|c|c|c|c|c|}
\hline Experimento&[A]_0\ (M)&[B]_0\ (M)&[C]_0\ (M)&r_i\ (M\cdot s^{-1})\\
\hline 1&1.20&1.20&1.00&r_1\\
\hline 2&0.60&1.20&1.00&r_2 = \frac{r_1}{2}\\
\hline 3&0.60&0.60&1.00&r_3 = \frac{r_2}{4}\\
\hline 4&1.20&1.20&0.50&r_4 = 16r_3\\
\hline 5&0.60&0.60&0.50&r_5\\
\hline
\end{tabular}](local/cache-TeX/bb1e2cd830b5351276c0a72627ce770d.png)
a) ¿Cuáles son los órdenes de reacción con respecto a los reactivos A, B y C?
b) ¿Cuál es el valor de 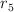 en términos de
en términos de 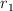 ?
?
c) ¿Es una reacción elemental? Justifica tu respuesta.
 Ecuación velocidad
Ecuación velocidad