-
Concentraciones molar y g/L de una solución comercial de ácido nítrico (6152)
Una disolución de 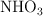 comercial tiene una concentración del
comercial tiene una concentración del 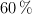 y una densidad de
y una densidad de 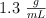 :
:
a) ¿Cuál es la concentración de la disolución expresada en mol/L y en g/L?
b) ¿Cómo prepararías 25 mL de una solución de 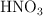 1.0 M a partir de la disolución comercial?
1.0 M a partir de la disolución comercial?
-
Volumen de ácido nítrico concentrado para hacer una disolución (6130)
Se dispone de una solución de ácido nítrico concentrado al 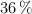 (m/m) y densidad de
(m/m) y densidad de 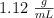 :
:
a) Calcula el volumen de disolución concentrada que se debe medir si se desea preparar 1.5 L de una disolución 0.125 M de ácido nítrico.
b) Calcula el volumen de agua que se debe adicionar si se desea ajustar la disolución preparada en el apartado anterior a una concentración 0.100 M.
-
Estandarización de una solución de NaOH y posterior valoración de una disolución de HCl (6094)
Un disolución de NaOH se estandariza con hidrogenoftalato de potasio y se registran los siguientes datos; masa de ftalato: 0.8707 g, lectura inicial de la bureta: 0.23 mL, lectura final de la bureta: 38.78 mL.
Posteriormente se utiliza esta disolución para la valoración de una disolución de HCl en la que una muestra de 30.0 mL necesitó un volumen de 34.21 mL de la disolución estandarizada. ¿Cuál es la molaridad de la disolución de HCl?
Masas atómicas: K = 39, C = 12, O = 16, H = 1, Na = 23.
-
Repaso: verdadero o falso sobre disoluciones (6083)
Razona si son verdaderas o falsas las siguientes afirmaciones y justifica tu respuesta.
a) El porcentaje (V/V) mide la concentración de una solución con relación al volumen de soluto en mL por cada 100 mL de solución.
b) Las disoluciones químicas tienen siempre una composición fija.
c) Una solución al 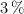 de cualquier sustancia equivale a tener 3 g de soluto en 17 g de agua.
de cualquier sustancia equivale a tener 3 g de soluto en 17 g de agua.
d) Una solución 3N de 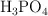 equivale a una solución 1 M del mismo ácido.
equivale a una solución 1 M del mismo ácido.
e) El peso de un equivalente gramo de hidróxido de aluminio es igual a la masa de un mol del mismo hidróxido.
f) A partir de una solución diluida se puede preparar otra solución de mayor concentración por medio de la evaporación.
g) Una forma de economizar reactivos en el laboratorio es utilizando la concentración de los reactivos en partes por millón.
h) Para determinar la molaridad de una solución es necesario conocer la cantidad de solvente presente en dicha solución.
-
Dilución seriada de un colorante concentrado
La concentración de una solución stock de un colorante es 0.25 M. Para utilizar este colorante en un proceso de tinción en el elaboratorio la concentración en la solución diluida debe estar en el rango entre 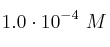 y
y 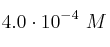 . ¿Cómo prepararías 5 mL de este colorante utilizando una dilución seriada?
. ¿Cómo prepararías 5 mL de este colorante utilizando una dilución seriada?
 Molaridad
Molaridad