-
Masa de sulfuro de cobre(II) que se obtiene tras la reacción del H2S con el CuCl2
Hacemos pasar 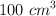 de
de 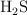 , medidos a
, medidos a 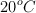 y 1 atm, a través de una disolución que contiene exceso de
y 1 atm, a través de una disolución que contiene exceso de 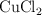 , formándose
, formándose 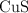 y
y 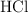 . Determina la masa de
. Determina la masa de 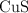 que se formará.
que se formará.
Masas atómicas: S = 32 ; Cu = 63.5.
-
Masa de fosfato de magnesio que se forma con 10 g de cabonato de magnesio
Al reaccionar 10 g de carbonato de magnesio con exceso de ácido fosfórico, ¿qué cantidad de sal se produce?
-
Reactivo sobrante: Relación másica en la reacción de aluminio y bromo (6502)
El aluminio y el bromo reaccionan según la reacción:
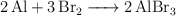
Se usan en la reacción 16 g de aluminio y 100 g de bromo, ¿cuál es la masa de reactivo sobrante?
Masas atómicas: Al = 27 y Br = 80.
-
Masa de ácido nicotínico y porcentaje en una muestra aislada
Una investigadora aísla una muestra de ácido nicotínico, 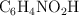 , un miembro importante del grupo vitamínico B. Para determinar su pureza, hace una valoración de 0.450 g de muestra con una disolución
, un miembro importante del grupo vitamínico B. Para determinar su pureza, hace una valoración de 0.450 g de muestra con una disolución 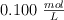 de
de 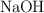 . Se necesitan 36.2 mL de la disolución de
. Se necesitan 36.2 mL de la disolución de 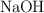 para alcanzar el punto final de la valoración. Calcula:
para alcanzar el punto final de la valoración. Calcula:
a) La masa, en gramos, de ácido nicotínico que contiene la muestra.
b) El porcentaje de ácido nicotínico en la muestra.
-
Volumen de hidrógeno y masa de HCl en la reacción con el magnesio (6484)
El magnesio reacciona con ácido clorhídrico para formar cloruro de magnesio y desprender dihidrógeno.
a) Escribe y ajusta la reacción.
b) ¿Qué volumen de gas hidrógeno a 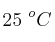 y 700 mm Hg se desprenderá al hacer reaccionar 7.2 g de magnesio con ácido clorhídrico en exceso?
y 700 mm Hg se desprenderá al hacer reaccionar 7.2 g de magnesio con ácido clorhídrico en exceso?
c) ¿Qué cantidad de ácido clorhídrico tiene que reaccionar para obtener 50 L de gas hidrógeno medidos en condiciones normales?
Datos: 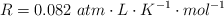 ; Mg = 24 ; H = 1 ; Cl = 35.5
; Mg = 24 ; H = 1 ; Cl = 35.5
 Reacciones químicas
Reacciones químicas