-
Reacción de formación del agua entre gases en distintas condiciones (4850)
Si tenemos 50 L de hidrógeno a 293 K y 2 atm y 30 L de oxígeno a 303 K y 3 atm, y los hacemos reaccionar para dar agua, ¿qué volumen de agua podremos obtener a 4 atm y 313 K? ¿Qué reactivo y en qué cantidad sobrará?
-
Fórmula empírica y molecular del DDT (4832)
El insecticida DDT contiene únicamente C, H y Cl. Cuando se quema una muestra de 1.5 g con oxígeno se obtienen 2.61 g dióxido de carbono y 0.343 g de agua, ¿cuál es la fórmula empírica del DDT? Si los 1.5 g de muestra, a 730 mm Hg y 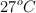 , ocupan
, ocupan 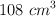 , ¿cuál es su fórmula molecular?
, ¿cuál es su fórmula molecular?
-
Fórmulas empírica y molecular de un compuesto nitrogenado (4831)
a) Un compuesto tiene un 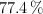 de carbono, un
de carbono, un 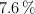 de hidrógeno y el resto de nitrógeno, ¿cuál es su fórmula empírica?
de hidrógeno y el resto de nitrógeno, ¿cuál es su fórmula empírica?
b) Si 558 g de este compuesto en estado gaseoso a  y 0.97 atm ocupan un volumen de 75.5 L, ¿cuál es su fórmula molecular?
y 0.97 atm ocupan un volumen de 75.5 L, ¿cuál es su fórmula molecular?
-
Volumen final de una muestra de NO al variar la temperatura (4816)
Una muestra de NO ocupa 20 mL cuando está a una temperatura de 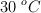 . ¿Cuál será su volumen, expresado en litros, a
. ¿Cuál será su volumen, expresado en litros, a 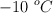 ? Considera que la presión del recipiente es constante.
? Considera que la presión del recipiente es constante.
-
Presión parcial de cada gas en función del volumen de cada uno
Siendo la presión total de un recipiente 680 torr, ¿cuál es la presión parcial de cada gas, sabiendo que están contenidos 4 litros de cloro, 7 litros de nitrógeno y 6 litros de oxígeno?
 Leyes de los gases
Leyes de los gases