-
Volumen de disolución de ácido sulfúrico y masa de cinc para obtener un volumen de hidrógeno (7284)
Para obtener 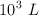 de hidrógeno, en condiciones normales, ¿qué volumen de ácido sulfúrico, de una riqueza del
de hidrógeno, en condiciones normales, ¿qué volumen de ácido sulfúrico, de una riqueza del 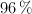 en peso y densidad de
en peso y densidad de 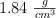 , y qué masa de cinc se necesitan?
, y qué masa de cinc se necesitan?
-
Reacción entre calcita y ácido sulfúrico (6609)
Una muestra de 15 g de calcita, que contiene un 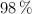 en peso de carbonato de calcio puro, se hace reaccionar con ácido sulfúrico del
en peso de carbonato de calcio puro, se hace reaccionar con ácido sulfúrico del 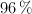 y densidad
y densidad 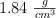 , formándose sulfato de calcio y desprendiéndose dióxido de carbono y agua.
, formándose sulfato de calcio y desprendiéndose dióxido de carbono y agua.
a) Formula y ajusta la reacción que tiene lugar.
b) ¿Qué volumen de ácido sulfúrico será necesario para que reaccione totalmente la muestra de calcita?
c) ¿Cuántos litros de  se desprenderán, medidos a 1 atm y
se desprenderán, medidos a 1 atm y  ?
?
d) ¿Cuántos gramos de sulfato de calcio se producirán en la reacción?
Datos. 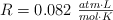 ; H = 1 ; C = 12 ; O = 16 ; S = 32 y Ca = 40.
; H = 1 ; C = 12 ; O = 16 ; S = 32 y Ca = 40.
-
Masa de alumnio impuro para reaccionar con una disolución dada (6589)
¿Qué masa de un aluminio comercial al 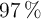 de riqueza es necesaria para la reacción completa con 100 mL de un ácido clohídrico comercial al
de riqueza es necesaria para la reacción completa con 100 mL de un ácido clohídrico comercial al 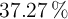 de pureza y densidad
de pureza y densidad 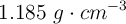 ?
?
Datos: H = 1 ; Cl = 35.5 ; Al = 27.
-
Reactivo limitante y masa de producto en la formación del KNO3 como fertilizante
El nitrato de potasio (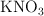 ) , muy usado como fertilizante, se obtiene a partir de la reacción entre el cloruro de potasio (
) , muy usado como fertilizante, se obtiene a partir de la reacción entre el cloruro de potasio (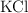 ) y el nitrato de sodio (
) y el nitrato de sodio (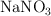 ) , obteniéndose además cloruro de sodio (
) , obteniéndose además cloruro de sodio (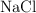 ). Si a 100 kg de
). Si a 100 kg de 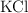 del
del 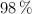 de riqueza se le agregan 400 L de disolución de
de riqueza se le agregan 400 L de disolución de 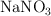 del
del 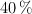 en masa y densidad
en masa y densidad 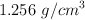 :
:
a) ¿Cuál es el reactivo limitante?
b) ¿Cuánto sobra del reactivo que está en exceso?
c) ¿Qué masa de 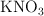 se ha obtenido si el rendimiento de la reacción es del
se ha obtenido si el rendimiento de la reacción es del 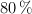 ?
?
Masas atómicas: K = 39 ; O = 16 ; N = 14 ; Cl = 35.5 ; Na =23.
-
Reactivo limitante y en exceso en la neutralización de HCl y NaOH (6520)
Se añaden 20 mL de ácido clorhídrico 8 M a un matraz que contiene 100 mL de una disolución de hidróxido de sodio 1.5 M, formándose cloruro de sodio y agua.
a) Escribe y ajusta la reacción.
b) Indicar cuál es el reactivo limitante y cuál está exceso.
c) Calcula la cantidad del reactivo en exceso que queda sin reaccionar.
Masas atómicas: H = 1 ; Cl =35.5
 Disoluciones
Disoluciones