-
Presiones parciales y cantidad de producto formado en un equilibrio heterogéneo (8434)
En un reactor de 5 litros se introduce una mezcla de óxido de hierro(III) sólido y monóxido de carbono gaseoso a una temperatura de 1 000 K. Se establece el siguiente equilibrio heterogéneo:

Se sabe que, a 1 000 K, la constante de equilibrio 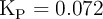 . Inicialmente, se introducen 2 moles de CO y una cantidad suficiente de
. Inicialmente, se introducen 2 moles de CO y una cantidad suficiente de 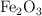 en el reactor:
en el reactor:
a) Calcula la presión parcial de CO y  en el equilibrio.
en el equilibrio.
b) Determina la cantidad de Fe formado en el equilibrio.
c) Si se añade más CO al sistema en equilibrio, ¿cómo afectará esto a la cantidad de Fe formado? Justifica tu respuesta utilizando el principio de Le Chatelier.
Datos: 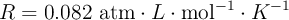 ;
; 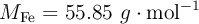
-
Concentraciones en el equilibrio de las sustancias de la disociación del metano (8399)
Se considera la disociación del metano en un reactor a 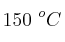 , siguiendo la reacción:
, siguiendo la reacción:
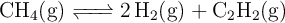
Se inyectan inicialmente 5 mol de 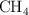 , 2 mol de
, 2 mol de 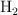 y 3 mol de
y 3 mol de 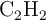 en un reactor, a la presión de 10 atm. Cuando se alcanza el equilibrio, la presión medida en el reactor es de 12 atm. Suponiendo que el volumen y la temperatura son constantes, calcula las concentraciones finales de cada especie en el equilibrio y el valor de la constante de equilibrio.
en un reactor, a la presión de 10 atm. Cuando se alcanza el equilibrio, la presión medida en el reactor es de 12 atm. Suponiendo que el volumen y la temperatura son constantes, calcula las concentraciones finales de cada especie en el equilibrio y el valor de la constante de equilibrio.
-
EBAU Andalucía: química (junio 2024) RESERVA - ejercicio C.1 (8242)
Se introducen 2 g de 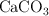 en un recipiente de 2 L y se calienta a
en un recipiente de 2 L y se calienta a 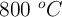 estableciéndose el siguiente equilibrio:
estableciéndose el siguiente equilibrio:
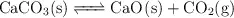
Calcula:
a) Las constantes  y
y  a esa temperatura si la presión en el equilibrio es de 0.236 atm.
a esa temperatura si la presión en el equilibrio es de 0.236 atm.
b) Los gramos de 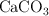 y de
y de 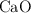 que hay en el recipiente después de que se alcance el equilibrio.
que hay en el recipiente después de que se alcance el equilibrio.
Datos: Ca = 40 ; O = 16 ; C = 12 ; 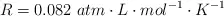
-
Moles de oxígeno para modificar la concentración de producto en un equilibrio (5331)
En un recipiente de 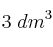 hay inicialmente 2 moles de dióxido de azufre gaseoso y 1 mol de trióxido de azufre gaseoso, a 700 K. Si se desea aumentar la concentración de trióxido de azufre hasta que llegue a 0.6 M:
hay inicialmente 2 moles de dióxido de azufre gaseoso y 1 mol de trióxido de azufre gaseoso, a 700 K. Si se desea aumentar la concentración de trióxido de azufre hasta que llegue a 0.6 M:
a) ¿Cuántos moles de oxígeno habrá que agregar al recipiente?
Considera el equilibrio y la constante  :
:
![\ce{SO2(g) + \textstyle{1\over 2}O2 (g) -> SO3(g)}\ \ [\ce{K_C = 18.9}] \ce{SO2(g) + \textstyle{1\over 2}O2 (g) -> SO3(g)}\ \ [\ce{K_C = 18.9}]](local/cache-TeX/b9b1e4c5bdf05810e5ce20c78100ce38.png)
-
EBAU Andalucía: química (junio 2023) - ejercicio C.1 (8037)
Dado el siguiente equilibrio:
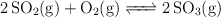
Se introducen 128 g de  y 64 g de
y 64 g de  en un recipiente cerrado de 2 L. Se calienta la mezcla y cuando se ha alcanzado el equilibrio, a
en un recipiente cerrado de 2 L. Se calienta la mezcla y cuando se ha alcanzado el equilibrio, a 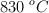 , ha reaccionado el
, ha reaccionado el 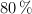 del
del  inicial. Calcula:
inicial. Calcula:
a) La composición en moles de la mezcla en el equilibrio y el valor de  .
.
b) La presión total de la mezcla en el equilibrio y el valor de  .
.
Datos: S = 32 ; O = 16 ; 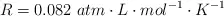
 Concentraciones
Concentraciones