-
Ampliación: relación entre magnitudes termodinámicas y equilibrio químico (8449)
a) Determina qué relación existe entre 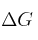 ,
, 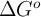 , Q y K, para un sistema que opera a P y T constantes, en forma reversible.
, Q y K, para un sistema que opera a P y T constantes, en forma reversible.
b) Calcula 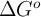 y
y 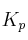 para la reacción siguiente, a 298 K:
para la reacción siguiente, a 298 K:

Busca los datos que necesites en Internet.
-
Entalpía de reacción y variación de energía libre en la combustión del etanol (6266)
El etanol puede ser utilizado como sustituto de la gasolina y su reacción de combustión a 298 K y 1 atm es:
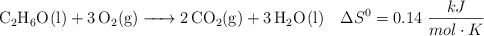
a) Calcula la entalpía de combustión del etanol.
b) Calcula la variación de energía libre del proceso.
Datos: 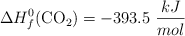 ;
; 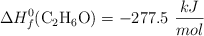 ;
; 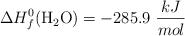
-
Energía libre de Gibbs y equilibrio químico (2619)
Para la reacción de formación de agua, a 298 K y 1 atm, según la ecuación:
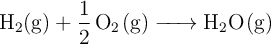
Los valores de entalpía y entropía estándar son: 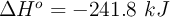 y
y 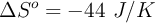
Calcula:
a) El valor de la variación de energía libre en estas condiciones.
b) La temperatura a la que el sistema no evoluciona por encontrarse en equilibrio, suponiendo que la entalpía y la entropía no varían con la temperatura.
-
Entalpías de formación, entropía y espontaneidad 0001
Las entalpías estándar de formación del etano y del eteno son -84,7 kJ/mol y 52,3 kJ/mol, respectivamente. Sabiendo que la variación de entropía del proceso 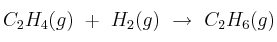 es
es 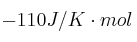 , indica de forma razonada si el proceso será espontáneo en condiciones estándar.
, indica de forma razonada si el proceso será espontáneo en condiciones estándar.
-
EBAU Andalucía: química (junio 2012) - ejercicio B.6 (1807)
Dada la ecuación termoquímica, a 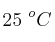 :
:

Calcula:
a) El calor de la reacción a volumen constante.
b) La energía libre de Gibbs a la temperatura de 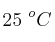 .
.
Datos: ![S^0[\ce{NH3(g)}] = 192.3\ J\cdot (mol\cdot K)^{-1} S^0[\ce{NH3(g)}] = 192.3\ J\cdot (mol\cdot K)^{-1}](local/cache-TeX/0ba576237cd2359701ffb3101fe044b1.png) ;
; ![S^0[\ce{N2(g)}] = 191\ J\cdot (mol\cdot K)^{-1} S^0[\ce{N2(g)}] = 191\ J\cdot (mol\cdot K)^{-1}](local/cache-TeX/66a3363ae2fb51e6a64f40d5f1344dd1.png) ;
; ![S^0[\ce{H2(g)}] = 130.8\ J\cdot (mol\cdot K)^{-1} S^0[\ce{H2(g)}] = 130.8\ J\cdot (mol\cdot K)^{-1}](local/cache-TeX/80f00905c3da256c5c9a06b5487ebaa0.png) ;
; 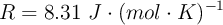
 Energía libre
Energía libre