-
Presión parcial de cada gas en una mezcla (6941)
La masa molar aparente de una mezcla gaseosa compuesta por 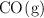 y
y 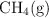 es 22.4 g/mol. Si 10 moles de la mezcla ocupan un volumen de 4.2 L a
es 22.4 g/mol. Si 10 moles de la mezcla ocupan un volumen de 4.2 L a 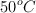 . Determina la presión parcial de cada gas.
. Determina la presión parcial de cada gas.
-
Ampliación: dilatación de un gas a presión constante (6039)
A 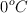 cierto gas ocupa un volumen de
cierto gas ocupa un volumen de 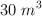 . Se le somete a un calentamiento a presión constante y se dilata un total de
. Se le somete a un calentamiento a presión constante y se dilata un total de 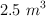 . Halla su temperatura final.
. Halla su temperatura final.
-
Presión de un recipiente que contiene una masa de oxígeno a cierta temperatura (6023)
Calcula la presión de un sistema cuya temperatura es de 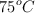 y presenta un volumen de 250 mL, conteniendo 44 g de
y presenta un volumen de 250 mL, conteniendo 44 g de  .
.
Datos: 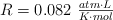 ;
; 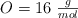 .
.
-
Verdadero o falso sobre sistemas gaseosos (5980)
Indica si los siguientes enunciados son verdaderos o falsos y corrige los que sean falsos:
a) Los gases están formados por un gran número de partículas muy pequeñas que se encuentran en reposo y siempre a la misma distancia unas de otras.
b) Cuando un gas se comprime las partículas se separan y cuando el gas se expande se aproximan entre sí.
c) Cuando se calienta un gas aumenta su temperatura porque las partículas se mueven más deprisa.
-
Aplicación de la teoría cinético-molecular a los sistemas gaseosos (5979)
a) Explica por qué un gas puede comprimirse en un volumen más pequeño.
b) ¿Por qué en un mismo recipiente es mayor la presión a medida que aumenta el número de partículas?
c) ¿Crees que dos gases pueden estar juntos en un mismo recipiente sin mezclarse? Justifica tu respuesta.
 Gases
Gases