-
pOH y concentración de OH- y H+ a partir del pH (8180)
Calcula el pOH, la ![[\ce{OH-}] [\ce{OH-}]](local/cache-TeX/d3ae778e752a042743bcfcf19b7a416d.png) y la
y la ![[\ce{H+}] [\ce{H+}]](local/cache-TeX/d24e886349b0c613c2d98794900bce5f.png) de las disoluciones que posean los siguientes pH: a) 0.0; b) 7.52; c) 3.3; d) 10.9; e) 14
de las disoluciones que posean los siguientes pH: a) 0.0; b) 7.52; c) 3.3; d) 10.9; e) 14
-
pH, pOH y concentración de OH- a partir de concentración de protones (8130)
Calcula el pH, el pOH y la ![[\ce{OH-}] [\ce{OH-}]](local/cache-TeX/d3ae778e752a042743bcfcf19b7a416d.png) en las disoluciones que poseen la siguiente concentración de ion hidrógeno: a)
en las disoluciones que poseen la siguiente concentración de ion hidrógeno: a) 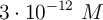 ; b)
; b) 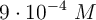 ; c)
; c) 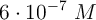 ; d) 1.0 M.
; d) 1.0 M.
-
Concentración de OH- de una solución, conocida su concentración de H+
¿Cuál será la concentración de ![[OH^-] [OH^-]](local/cache-TeX/38fd0dbf794f97d049e4f0e8bc6351bf.png) de una solución si su concentración de
de una solución si su concentración de ![[H^+] [H^+]](local/cache-TeX/7da3592729477229d8821cccd072f7b9.png) es 0.032 M?
es 0.032 M?
-
Concentraciones en el equilibrio de todas las especies en una disolución de ácido clórico (5107)
En condiciones ambientales normales, 1 atm y 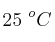 , se tiene 1 litro de agua (
, se tiene 1 litro de agua (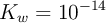 ), de densidad 1 g/mL. Se le agregan 3 moles de ácido clórico, considerando que no varía el volumen, con (
), de densidad 1 g/mL. Se le agregan 3 moles de ácido clórico, considerando que no varía el volumen, con (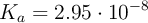 ). Considerando que la concentración de los protones en el sistema depende significativamente del ácido, es decir, ignorando lo que el agua pueda o no aportar, calcula las concentraciones molares de todas las especies:
). Considerando que la concentración de los protones en el sistema depende significativamente del ácido, es decir, ignorando lo que el agua pueda o no aportar, calcula las concentraciones molares de todas las especies: 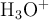 ,
, 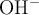 ,
, 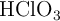 y
y 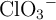 .
.
-
EBAU Andalucía: química (junio 2018) - ejercicio B.4 (4655)
a) Según la teoría de Brönsted-Lowry, justifica, mediante las correspondientes reacciones químicas, el carácter ácido, básico o neutro de disoluciones acuosas de HCl y de 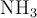
b) Según la teoría de Brönsted-Lowry, escribe la reacción que se produciría al disolver etanoato de sodio (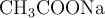 ) en agua, así como el carácter ácido, básico o neutro de dicha disolución.
) en agua, así como el carácter ácido, básico o neutro de dicha disolución.
c) Se tienen tres disoluciones acuosas de las que se conocen: de la primera ![[\ce{OH-}] = 10^{-4}\ M [\ce{OH-}] = 10^{-4}\ M](local/cache-TeX/184e03b613f964e48f158ac3674527f0.png) , de la segunda la
, de la segunda la ![[\ce{H3O+}] = 10^{-4}\ M [\ce{H3O+}] = 10^{-4}\ M](local/cache-TeX/678b4522242e41e99652d9988e542822.png) y de la tercera la
y de la tercera la ![[\ce{OH-}] = 10^{-7}\ M [\ce{OH-}] = 10^{-7}\ M](local/cache-TeX/50db972e2c2aca58a57033ee362ecd5a.png) . Ordénalas, justificadamente, en función de su acidez.
. Ordénalas, justificadamente, en función de su acidez.
 Producto iónico agua
Producto iónico agua