-
Descomposición del ácido nítrico por la luz (8094)
El ácido nítrico se descompone, por acción de la luz, en dióxido de nitrógeno, oxígeno y agua. Si se obtienen 40.5 g de agua en la descomposición:
a) ¿Qué cantidad de ácido habrá reaccionado?
b) ¿Cuántos moles de dióxido de nitrógeno y oxígeno se obtienen?
c) ¿Qué volumen ocupa la mezcla de gases anterior en condiciones estándar (1 atm y 298 K)?
Masas atómicas: H = 1 ; N = 14 ; O = 16.
-
Volumen de aire para quemar un mol de glucosa (7881)
¿Qué volumen de aire, medido a 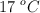 y 1.2 atm, teniendo en cuenta que el aire contiene un 21 % de oxígeno y un 79 % en moles de nitrógeno, se necesita para la total combustión de 1 mol de glucosa (
y 1.2 atm, teniendo en cuenta que el aire contiene un 21 % de oxígeno y un 79 % en moles de nitrógeno, se necesita para la total combustión de 1 mol de glucosa (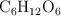 ) según la reacción:
) según la reacción:

-
Masa de agua que se obtiene al reaccionar volúmenes de oxígeno e hidrógeno (7852)
El hidrógeno y el oxígeno gaseosos reaccionan, en condiciones adecuadas, dando agua líquida. Si se hacen reaccionar 10 L de 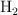 con 3.5 L de
con 3.5 L de  medidos en condiciones normales, ¿qué masa de agua se obtendrá?
medidos en condiciones normales, ¿qué masa de agua se obtendrá?
Masas atómicas: H = 1 ; O = 16.
-
Masa de carbonato de calcio que reacciona con HCl y volumen de CO2 producido (7808)
Al añadir ácido clorhídrico al carbonato de calcio se forma cloruro de calcio, dióxido de carbono y agua.
a) Escribe la reacción y calcula la cantidad, en kilogramos, de carbonato de calcio que reaccionará con 20 L de ácido clorhídrico 3 M.
b) ¿Qué volumen ocupará el dióxido de carbono obtenido, medido a 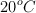 y 1 atm?
y 1 atm?
Datos: 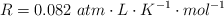 . Masas atómicas: C = 12 ; O = 16 ; Ca = 40.
. Masas atómicas: C = 12 ; O = 16 ; Ca = 40.
-
Volumen de amoniaco a partir de volúmenes iguales de hidrógeno y nitrógeno (7564)
Si se hicieran reaccionar 4.50 L de 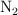 con 4.50 L de
con 4.50 L de 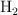 , ambos a
, ambos a 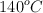 y 720 torr. ¿Qué volumen de amoniaco gaseoso,
y 720 torr. ¿Qué volumen de amoniaco gaseoso, 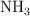 , se produciría a
, se produciría a 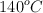 y 720 torr?
y 720 torr?
 Gases
Gases