-
Molaridad de una disolución conocida su presión osmótica (7192)
Al disolver 20 g de una sustancia no electrolítica y no volátil en 400 mL de agua, se obtiene una solución cuya presión osmótica a 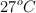 es de 5 atm. Calcula la masa molar (M) de la sustancia.
es de 5 atm. Calcula la masa molar (M) de la sustancia.
-
Volumen en el que disolver urea para obtener una presión osmótica dada (7144)
En que volumen de solución hay que disolver 30 g de urea, cuyo peso molecular es 60 g/mol, para que su presión, a  , sea de 4 atm.
, sea de 4 atm.
-
Ampliación: presión osmótica en disoluciones de electrolitos y no electrolitos (6044)
Se prepararon dos tubos en U con disoluciones 1 M separadas por una membrana semipermeable. En el tubo A se puso una disolución de NaCl y otra de KCl y en el tubo B se colocó una disolución de glucosa y otra de cloruro de sodio.
En el tubo A no ocurrió nada y en ambos brazos del tubo las soluciones permanecen en el mismo nivel. En el tubo B se observa un aumento del volumen en el brazo del tubo correspondiente a la disolución de NaCl.
1. Analiza las semejanzas y diferencias existentes entre los solutos utilizados en cada uno de los tubos y propón una hipótesis de lo observado.
2. Si las disoluciones tienen la misma concentración, ¿por qué crees que en el tubo B el gradiente de transporte a través de la membrana va de la disolución de glucosa a la de NaCl?
-
Masa de nitrato de cinc necesaria para una disolución isotónica (5613)
Un gramo de sacarosa (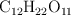 ) está disuelto en
) está disuelto en 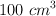 de agua a la temperatura de
de agua a la temperatura de 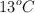 . Halla los gramos de nitrato de cinc disueltos en
. Halla los gramos de nitrato de cinc disueltos en 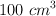 de agua que forman una disolución isotónica a la anterior, teniendo en cuenta que a
de agua que forman una disolución isotónica a la anterior, teniendo en cuenta que a 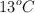 el nitrato de cinc está ionizado al
el nitrato de cinc está ionizado al 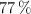 .
.
Masas atómicas: H = 1 ; C = 12 ; N = 14 ; O = 16 ; Zn = 65.
-
Peso molecular de una proteína conocida su presión osmótica (5608)
Una solución que contiene 2.70 gramos de una proteína disueltos en 100 gramos de agua tiene una presión osmótica de 9.12 mm Hg a  . Calcula el peso molecular de la proteína. Puedes considerar que un gramo de agua es igual a 1 mL de agua.
. Calcula el peso molecular de la proteína. Puedes considerar que un gramo de agua es igual a 1 mL de agua.
 Presión osmótica
Presión osmótica