-
Comparación de volumen y masa de dos gases en las mismas condiciones de P y T (8155)
Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, contesta razonadamente a las siguientes cuestiones:
a) ¿Qué ocupará más volumen, un mol de hidrógeno o un mol de oxígeno en las mismas condiciones de presión y temperatura?
b) ¿Qué tendrá más masa, un mol de hidrógeno o un mol de oxígeno?
c) ¿Dónde habrá más moléculas, en un mol de hidrógeno o en un mol de oxígeno?
-
¿Explotará una bombona que se calienta hasta los 800 ºC? (8147)
Una bombona de 3 L contiene  que, a temperatura ambiente (
que, a temperatura ambiente (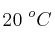 ), ejerce una presión de 2 atm. En un descuido, la bombona se acerca a un fuego y llega a alcanzar los
), ejerce una presión de 2 atm. En un descuido, la bombona se acerca a un fuego y llega a alcanzar los 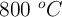 , dilatando su volumen un
, dilatando su volumen un 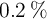 . ¿Llegará a explotar? La bombona está hecha de un material que soporta hasta 8.5 atm de presión.
. ¿Llegará a explotar? La bombona está hecha de un material que soporta hasta 8.5 atm de presión.
-
Deducción de la ecuación de estado de los gases (8144)
Deduce la ecuación de estado de los gases ideales suponiendo que el gas pasa del estado A a B, en un proceso con volumen constante, y de B a C en un proceso con temperatura constante.
-
Repaso: leyes de los gases aplicadas sobre un volumen de etileno (7562)
Tenemos una pipeta con etileno (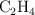 ), que se utiliza en la maduración del plátano, con un volumen de 2 000 mL, una presión de 890 mm Hg y una temperatura de
), que se utiliza en la maduración del plátano, con un volumen de 2 000 mL, una presión de 890 mm Hg y una temperatura de 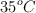 .
.
a) Calcula la presión final, en bares, si el gas se pasa a una pipeta con el triple de volumen y la temperatura permanece constante.
b) Calcula el cambio de temperatura si la presión disminuye hasta 450 mm Hg y el volumen sigue constante.
c) Calcula el cambio de volumen si la temperatura disminuye hasta 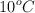 y la presión se mantiene constante.
y la presión se mantiene constante.
d) Calcula la masa de gas presente en las condiciones iniciales utilizando la ecuación de los gases ideales.
-
Repaso: ley general de los gases (7513)
Cierta masa de 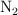 ocupa, en condiciones normales de presión y temperatura, un volumen de 18 L. ¿Qué volumen ocupará si se aumenta la presión a 2 atm y se lleva la temperatura a
ocupa, en condiciones normales de presión y temperatura, un volumen de 18 L. ¿Qué volumen ocupará si se aumenta la presión a 2 atm y se lleva la temperatura a 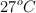 ?
?
 Leyes de los gases
Leyes de los gases