-
EBAU Andalucía: química (junio 2023) - ejercicio B.4 (8031)
La metilamina, 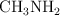 , es una base débil de acuerdo con la teoría de Brönsted-Lowry.
, es una base débil de acuerdo con la teoría de Brönsted-Lowry.
a) Escribe su equilibrio de disolución acuosa.
b) Escribe la expresión de su constante de basicidad, 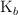 .
.
c) ¿Podría un disolución acuosa de metilamina tener un valor de pH = 5? Razona la respuesta.
-
pH de un búfer de amoniaco y amonio (6608)
Se preparó una solución reguladora agregando a 1.0 L de solución de amoniaco, de concentración 3.4 g/L, cloruro de amonio en cantidad suficiente para que su concentración fuera 0.15 M. Calcula el pH de dicho amortiguador.
Dato: 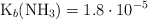 .
.
-
pH de una disolución de metilamina y pH del búfer formado al añadir cloruro de metilamonio (5518)
a) Se dispone de una disolución acuosa de metilamina 0.25 M. Sabiendo que su 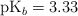 , ¿cuál es el pH de la disolución? Escribe la ecuación de disociación.
, ¿cuál es el pH de la disolución? Escribe la ecuación de disociación.
b) A 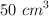 de la disolución anterior se le añaden
de la disolución anterior se le añaden 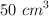 de una disolución 0.40 M de cloruro de metilamonio. Calcula el pH de la nueva disolución. Escribe el equilibrio que se establece y cómo actúa la mezcla búfer si se agrega NaOH.
de una disolución 0.40 M de cloruro de metilamonio. Calcula el pH de la nueva disolución. Escribe el equilibrio que se establece y cómo actúa la mezcla búfer si se agrega NaOH.
-
pH final de una mezcla de disoluciones de HCl y NH3 (5471)
¿Qué pH tendrá una disolución de 20.0 mL de HCl de concentración 0.5 M a la que se le añaden 60.0 mL de 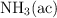 de 0.5 M de concentración?
de 0.5 M de concentración?
Dato: 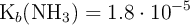
-
pH y dilución Opción A EBAU Andalucía junio 2017
a) El grado de disociación de una disolución 0,03 M de hidróxido de amonio (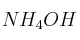 ) es 0,024. Calcula la constante de disociación (
) es 0,024. Calcula la constante de disociación (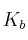 ) del hidróxido de amonio y el pH de la disolución.
) del hidróxido de amonio y el pH de la disolución.
b) Calcula el volumen de agua que hay que añadir a 100 mL de una disolución de NaOH 0,03 M para que el pH sea 11,5.
 Constante basicidad
Constante basicidad