-
Comparación de volumen y masa de dos gases en las mismas condiciones de P y T (8155)
Sabiendo que la masa molecular de hidrógeno es 2 y la del oxígeno 32, contesta razonadamente a las siguientes cuestiones:
a) ¿Qué ocupará más volumen, un mol de hidrógeno o un mol de oxígeno en las mismas condiciones de presión y temperatura?
b) ¿Qué tendrá más masa, un mol de hidrógeno o un mol de oxígeno?
c) ¿Dónde habrá más moléculas, en un mol de hidrógeno o en un mol de oxígeno?
-
Relación entre la densidad y la presión de dos sistemas gaseosos (8104)
Dos recipientes de igual volumen contiene números diferentes de moles del mismo gas. El recipiente B tiene cuatro veces más moles que el recipiente A. Si ambos recipientes están a la misma temperatura:
a) ¿Cual es la relación de la densidad del gas en el recipiente?
b) ¿Cuál debe ser la relación de las presiones del gas?
-
EBAU Andalucía: química (junio 2023) - ejercicio C.4 (8043)
En una celda electrolítica que contiene 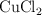 fundido se hace pasar una cierta cantidad de corriente durante 2 h, observándose que se deposita cobre metálico y se desprende dicloro. Basándote en las semirreacciones correspondientes:
fundido se hace pasar una cierta cantidad de corriente durante 2 h, observándose que se deposita cobre metálico y se desprende dicloro. Basándote en las semirreacciones correspondientes:
a) Determina la intensidad de corriente necesaria para depositar 15.9 g de Cu.
b) Calcula el volumen de 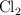 obtenido a
obtenido a 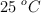 y 1 atm.
y 1 atm.
Datos: Cu = 63.5 ; 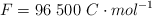 ;
; 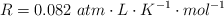 .
.
-
Presión parcial de un gas en una mezcla cuando se triplica la presión (7883)
Un recipiente rígido de 2 L de capacidad contiene 0.18 g de nitrógeno gaseoso a 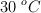 . Si se agrega argón gaseoso a la misma temperatura hasta que la presión inicial del recipiente se triplica, ¿cuál será la presión parcial de Ar en la solución gaseosa resultante?
. Si se agrega argón gaseoso a la misma temperatura hasta que la presión inicial del recipiente se triplica, ¿cuál será la presión parcial de Ar en la solución gaseosa resultante?
-
Recipiente con nitrógeno que se abre para igualar la presión (7560)
Un recipiente de 5 L de capacidad contiene 14 g de nitrógeno, a la temperatura de 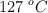 . La presión exterior es de 760 mm Hg. Se abre el recipiente hasta que se iguale su presión con la exterior. Calcula:
. La presión exterior es de 760 mm Hg. Se abre el recipiente hasta que se iguale su presión con la exterior. Calcula:
a) La cantidad de nitrógeno que sale.
b) La temperatura que debiera tener el nitrógeno que queda en el recipiente si se deseara que tuviera la presión inicial.
 Ecuación de los gases ideales
Ecuación de los gases ideales