-
Presiones parciales y cantidad de producto formado en un equilibrio heterogéneo (8434)
En un reactor de 5 litros se introduce una mezcla de óxido de hierro(III) sólido y monóxido de carbono gaseoso a una temperatura de 1 000 K. Se establece el siguiente equilibrio heterogéneo:

Se sabe que, a 1 000 K, la constante de equilibrio 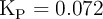 . Inicialmente, se introducen 2 moles de CO y una cantidad suficiente de
. Inicialmente, se introducen 2 moles de CO y una cantidad suficiente de 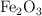 en el reactor:
en el reactor:
a) Calcula la presión parcial de CO y  en el equilibrio.
en el equilibrio.
b) Determina la cantidad de Fe formado en el equilibrio.
c) Si se añade más CO al sistema en equilibrio, ¿cómo afectará esto a la cantidad de Fe formado? Justifica tu respuesta utilizando el principio de Le Chatelier.
Datos: 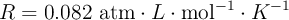 ;
; 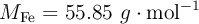
-
EBAU Andalucía: química (junio 2024) - ejercicio B.2 (8258)
El metanol se prepara industrialmente según el proceso siguiente:
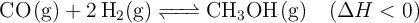
Razona cómo afectaría al rendimiento de la reacción:
a) Aumentar la temperatura.
b) Retirar del reactor el 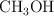 a medida que se vaya produciendo.
a medida que se vaya produciendo.
c) Aumentar la presión del sistema a temperatura constante.
-
EBAU Andalucía: química (junio 2024) RESERVA - ejercicio B.6 (8241)
Al añadir una pequeña cantidad de 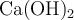 sólido a un vaso con agua se observa que no se disuelve por completo, quedando parte del sólido en equilibrio con la disolución saturada.
sólido a un vaso con agua se observa que no se disuelve por completo, quedando parte del sólido en equilibrio con la disolución saturada.
a) A partir del equilibrio correspondiente, deduce la relación entre la solubilidad molar de este compuesto y su producto de solubilidad.
b) Razona si aumentará la solubilidad del 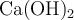 añadiendo a la disolución
añadiendo a la disolución 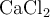 , que es una sal muy soluble.
, que es una sal muy soluble.
c) Justifica si cambiará el producto de solubilidad del 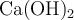 al añadir NaOH a la disolución saturada.
al añadir NaOH a la disolución saturada.
-
Principio de Le Châtelier en un equilibrio heterogéneo (8207)
Si se introduce una cierta cantidad de 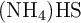 sólido en un recipiente cerrado y se calienta a
sólido en un recipiente cerrado y se calienta a 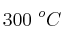 , se descompone estableciéndose el equilibrio:
, se descompone estableciéndose el equilibrio:
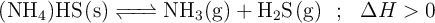
Con estos datos, razona sobre la veracidad o falsedad de las siguientes afirmaciones:
a) Cuando el volumen del recipiente se duplica, la cantidad de 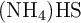 se reduce.
se reduce.
b) Cuando aumenta la temperatura disminuye la presión parcial de amoníaco.
c) El valor de la constante de equilibrio 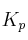 es independiente de la temperatura.
es independiente de la temperatura.
-
Aplicación del principio Le Châtelier y relación entre Kp y Kc (8206)
Para la reacción:

la constante de equilibrio de la reacción (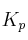 ) aumenta al aumentar la temperatura.
) aumenta al aumentar la temperatura.
a) Explica, de forma razonada, tres maneras de conseguir una reducción más eficiente del dióxido de estaño sólido.
b) ¿Qué relación existe entre 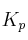 y
y 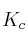 en este equilibrio?
en este equilibrio?
 Le Chatelier
Le Chatelier