-
PAU Andalucía: química (junio 2025) - pregunta 3 - ejercicio 3A (8479)
El equilibrio de descomposición del 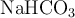 puede expresarse como:
puede expresarse como:
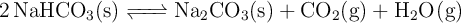
Para estudiar este equilibrio en el laboratorio, se depositaron 200 g de 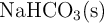 en un recipiente cerrado de 25 L, en el que previamente se hizo el vacío y se calentó a
en un recipiente cerrado de 25 L, en el que previamente se hizo el vacío y se calentó a 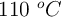 . La presión en el interior del recipiente, una vez alcanzado el equilibrio, fue de 1.65 atm. Calcula:
. La presión en el interior del recipiente, una vez alcanzado el equilibrio, fue de 1.65 atm. Calcula:
a) La masa de 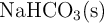 que queda en el recipiente tras alcanzarse el equilibrio a
que queda en el recipiente tras alcanzarse el equilibrio a 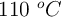 .
.
b) El valor de  y
y  a esa temperatura.
a esa temperatura.
Dato: 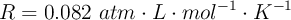 . Masas atómicas relativas: Na= 23; O= 16; C= 12; H= 1
. Masas atómicas relativas: Na= 23; O= 16; C= 12; H= 1
-
Ampliación: relación entre magnitudes termodinámicas y equilibrio químico (8449)
a) Determina qué relación existe entre 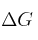 ,
, 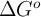 , Q y K, para un sistema que opera a P y T constantes, en forma reversible.
, Q y K, para un sistema que opera a P y T constantes, en forma reversible.
b) Calcula 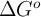 y
y 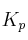 para la reacción siguiente, a 298 K:
para la reacción siguiente, a 298 K:

Busca los datos que necesites en Internet.
-
Presiones parciales y cantidad de producto formado en un equilibrio heterogéneo (8434)
En un reactor de 5 litros se introduce una mezcla de óxido de hierro(III) sólido y monóxido de carbono gaseoso a una temperatura de 1 000 K. Se establece el siguiente equilibrio heterogéneo:

Se sabe que, a 1 000 K, la constante de equilibrio 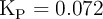 . Inicialmente, se introducen 2 moles de CO y una cantidad suficiente de
. Inicialmente, se introducen 2 moles de CO y una cantidad suficiente de 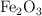 en el reactor:
en el reactor:
a) Calcula la presión parcial de CO y  en el equilibrio.
en el equilibrio.
b) Determina la cantidad de Fe formado en el equilibrio.
c) Si se añade más CO al sistema en equilibrio, ¿cómo afectará esto a la cantidad de Fe formado? Justifica tu respuesta utilizando el principio de Le Chatelier.
Datos: 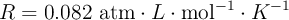 ;
; 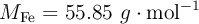
-
Concentraciones en el equilibrio de las sustancias de la disociación del metano (8399)
Se considera la disociación del metano en un reactor a 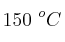 , siguiendo la reacción:
, siguiendo la reacción:
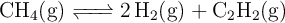
Se inyectan inicialmente 5 mol de 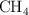 , 2 mol de
, 2 mol de 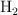 y 3 mol de
y 3 mol de 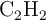 en un reactor, a la presión de 10 atm. Cuando se alcanza el equilibrio, la presión medida en el reactor es de 12 atm. Suponiendo que el volumen y la temperatura son constantes, calcula las concentraciones finales de cada especie en el equilibrio y el valor de la constante de equilibrio.
en un reactor, a la presión de 10 atm. Cuando se alcanza el equilibrio, la presión medida en el reactor es de 12 atm. Suponiendo que el volumen y la temperatura son constantes, calcula las concentraciones finales de cada especie en el equilibrio y el valor de la constante de equilibrio.
-
EBAU Andalucía: química (junio 2024) - ejercicio C.1 (8271)
El 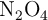 se descompone en
se descompone en 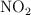 , estableciéndose el siguiente equilibrio:
, estableciéndose el siguiente equilibrio:

En un recipiente de 0.5 L se introducen 0.025 moles de 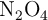 a
a 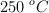 . Una vez alcanzado el equilibrio, la presión total es de 3.86 atm. Calcula:
. Una vez alcanzado el equilibrio, la presión total es de 3.86 atm. Calcula:
a) La presión parcial de cada gas en el equilibrio y el valor de  a la temperatura dada.
a la temperatura dada.
b) El grado de disociación del 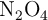 y el valor de
y el valor de  a la temperatura dada.
a la temperatura dada.
Dato: 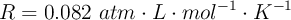
 Constante equilibrio
Constante equilibrio