Se tienen 2 g de un producto alimenticio que son descompuestos mediante reacciones químicas, por lo que el nitrógeno pasa al estado de ión amonio. Después del ataque el líquido se diluye, se alcaliniza y se destila. El ![]() desprendido se neutraliza con 25 mL de
desprendido se neutraliza con 25 mL de ![]() (0,5 N). Al final de la destilación, el exceso de ácido se valora con NaOH, gastándose 16,4 mL de la solución 0,5 M. Determina el porcentaje de nitrógeno en el producto.
(0,5 N). Al final de la destilación, el exceso de ácido se valora con NaOH, gastándose 16,4 mL de la solución 0,5 M. Determina el porcentaje de nitrógeno en el producto.
Una muestra que contiene ![]() y
y ![]() tiene una masa de 8.88 g y fue tratada a fin de precipitar todo el calcio como carbonato de calcio (
tiene una masa de 8.88 g y fue tratada a fin de precipitar todo el calcio como carbonato de calcio (![]() ) el cual fue posteriormente calentado y convertido en
) el cual fue posteriormente calentado y convertido en ![]() puro. La masa de
puro. La masa de ![]() final formada fue de 1.12 g- Determina el porcentaje en masa de
final formada fue de 1.12 g- Determina el porcentaje en masa de ![]() en la mezcla original.
en la mezcla original.
Masas moleculares (![]() ):
): ![]() ;
; ![]() ;
; ![]() .
.
Un recipiente de 1 L contiene hidrógeno gaseoso a 326 torr y ![]() y oxígeno gaseoso a 652 torr y la misma temperatura. Se hace saltar una chispa en el seno de la mezcla a fin de que se produzca la reacción:
y oxígeno gaseoso a 652 torr y la misma temperatura. Se hace saltar una chispa en el seno de la mezcla a fin de que se produzca la reacción:
![]()
¿Cuál será la presión final en el recipiente, si la temperatura final es ![]() ?
?
La reacción entre el cinc y el ácido clorhídrico produce cloruro de cinc e hidrógeno. Para determinar la riqueza de un cinc muy impuro se tomaron 5 g de muestra y se hicieron reaccionar con ácido clorhídrico en exceso. El volumen de hidrógeno producido fue de ![]() , medido a 1 atm y 298 K, ¿qué porcentaje de cinc hay en la muestra?
, medido a 1 atm y 298 K, ¿qué porcentaje de cinc hay en la muestra?
Datos: 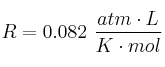 ; Zn = 65.3 g/mol.
; Zn = 65.3 g/mol.
Se pone en un recipiente 1.0 g de un solido que contiene cinc y se agregan 1.30 mL de acido clorhídrico al ![]() en masa y densidad
en masa y densidad ![]() . Si la única reacción que se verifica es:
. Si la única reacción que se verifica es:
![]()
Indica la pureza del sólido en cinc, expresado en porcentaje en masa.
La combustión del n-pentano ![]() se hace con exceso de oxígeno a
se hace con exceso de oxígeno a ![]() y presión atmosférica:
y presión atmosférica:
a) ¿Cuál será la masa de agua que se obtiene si se queman 120 L de n-pentano? A la temperatura indicada el hidrocarburo es líquido y su densidad es 0.626 kg/L.
b) ¿Qué volumen de dióxido de carbono se obtendrá, medido en las condiciones de la combustión?
c) ¿Cuántas moléculas de oxígeno serán las necesarias para hacer la combustión?
Datos: C = 12 ; H = 1 ; O = 16 ; 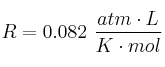 ;
; ![]()
La combustión del heptano ![]() se hace con exceso de oxígeno a
se hace con exceso de oxígeno a ![]() y presión atmosférica:
y presión atmosférica:
a) ¿Cuál será la masa de agua que se obtiene si se queman 65 L de heptano? A la temperatura indicada el hidrocarburo es líquido y su densidad es 0,684 kg/L.
b) ¿Qué volumen de dióxido de carbono se obtendrá, medido en las condiciones de la combustión?
c) ¿Cuántas moléculas de oxígeno serán las necesarias para hacer la combustión?
Datos: C = 12 ; H = 1 ; O = 16 ; 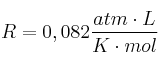 ;
; 
Si tenemos 50 L de hidrógeno a 293 K y 2 atm y 30 L de oxígeno a 303 K y 3 atm, y los hacemos reaccionar para dar agua, ¿qué volumen de agua podremos obtener a 4 atm y 313 K? ¿Qué reactivo y en qué cantidad sobrará?
¿Cuál es la molaridad de una disolución de NaOH si 32,45 mL necesitaron, en un proceso de neutralización, 38,32 mL de HCl de concentración 0,1 M?
Una muestra de 250 mL de ![]() 0.04 M se agregó a 15 mL de
0.04 M se agregó a 15 mL de ![]() 0.10 M.
0.10 M.
a) ¿La disolución resultante es básica o ácida? Razona tu respuesta.
b) ¿Cuántos moles de ácido o base quedan en exceso?
c) ¿Qué volumen de ![]() 0.04 M o de
0.04 M o de ![]() 0.10 M se necesitan para neutralizar la disolución resultante.
0.10 M se necesitan para neutralizar la disolución resultante.
 Ejercicios FyQ
Ejercicios FyQ